
【题目】含氯化合物在工业上有着广泛的用途。
Ⅰ.高氯酸铵(NH4ClO4)常作火箭发射的推进剂,实验室可用NaClO4与NH4Cl制取。
(部分物质溶解度如图1、图2),流程如图3:
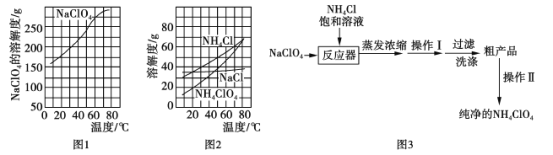
(1)反应器中发生反应的化学方程式为_______。
(2)上述流程中操作Ⅰ为__________,操作Ⅱ为__________。
(3)上述流程中采取的最佳过滤方式应为__________(填字母代号)
A.升温至80℃以上趁热过滤
B.降温至0℃左右趁冷过滤
C.0℃-80℃间任一温度过滤
Ⅱ.一氯化碘(沸点97.4℃)是一种红棕色易挥发的液体,不溶于水,溶于乙醇和乙酸。某学习小组拟用干燥、纯净的氯气与碘反应制备一氯化碘,其装置如下:(已知碘与氯气的反应为放热反应)
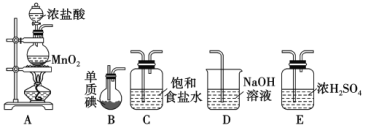
(1)各装置连接顺序为A→___________→___________→___________→___________
(2)B装置烧瓶需放在冷水中,其目的是___________,D装置的作用是________________。
(3)将B装置得到的液态产物进一步提纯可得到较纯净的ICl,则提纯采取的操作名称是___。
【答案】NH4Cl+NaClO4=NaCl+NH4ClO↓ 冷却结晶 重结晶 B C E B D 防止ICl挥发 吸收未反应的氯气,防止污染空气 蒸馏
【解析】
I.(1)根据氯化铵和高氯酸铵反应生成氯化钠和高氯酸铵沉淀进行分析;
(2)根据高氯酸铵的溶解度受温度变化影响较大,NH4Cl的溶解度受温度影响变化也较大,相对来说NH4ClO4受温度影响变化更大进行分析;
(3)根据高氯酸铵在0℃时的溶解度小于80℃时的溶解度进行分析;
II. (1)用干燥纯净的氯气与碘反应制备一氯化碘,A装置制备氯气,制得的氯气中含有HCl气体和水蒸气,先用饱和食盐水除HCl气体,再用浓硫酸干燥,将干燥的氯气通入B中与碘反应制备ICl,碘与氯气的反应为放热反应,而ICl沸点低挥发,所以B应放在冷水中,最后用氢氧化钠处理未反应完的氯气。
(1)氯化铵和高氯酸铵反应生成氯化钠和高氯酸铵沉淀,化学方程式为:NH4Cl+NaClO4=NaCl+NH4ClO4↓;
(2)高氯酸铵的溶解度受温度变化影响较大,所以上述流程中操作Ⅰ为冷却结晶;通过该方法得到的高氯酸铵晶体中含有较大的杂质,将得到的粗产品溶解,配成高温下的饱和溶液,再降温结晶析出,这种分离混合物的方法叫重结晶;
(3)高氯酸铵在0℃时的溶解度小于80℃时的溶解度,所以洗涤粗产品时,宜用0℃冷水洗涤,合理选项是B;
II. (1)用干燥纯净的氯气与碘反应制备一氯化碘,A装置制备氯气,制得的氯气中含有HCl气体和水蒸气,先用饱和食盐水除HCl气体,再用浓硫酸干燥,将干燥的氯气通入B中与碘反应制备ICl,碘与氯气的反应为放热反应,而ICl沸点低挥发,所以B应放在冷水中,最后用氢氧化钠处理未反应完的氯气。故各装置连接顺序为A→C→E→B→D;
(2)B装置烧瓶需放在冷水中,其目的是:防止ICl挥发,D装置的作用是:吸收未反应的氯气,防止污染空气;
(3)一氯化碘沸点97.4℃,则B装置得到的液态产物进一步蒸馏或蒸馏,收集97.4℃的馏分可得到较纯净的ICl。


科目:高中化学 来源: 题型:
【题目】著名的“侯氏制碱法”主要反应原理是:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。若实验室根据此原理制备少量的Na2CO3,主要实验包括:制取NH3和CO2→生成NaHCO3→分离NaHCO3→制取Na2CO3 四个步骤。下列实验选用的主要仪器或主要步骤不正确的是
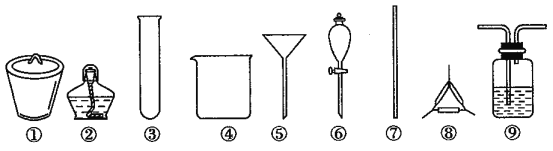
A. 制取氨气,可选用②③
B. 分离 NaHCO3,可选用④⑤⑦
C. 制取 Na2CO3,可选用①②⑦⑧
D. 制取 NaHCO3时,应先在⑨中通入CO2后再加入氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中,发生反应:X2(g)+Y2(g)![]() 2Z(g),某时刻测得容器内X2、Y2、Z的浓度分别为0.2mol/L、0.4mol/L、0.4mol/L,则当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),某时刻测得容器内X2、Y2、Z的浓度分别为0.2mol/L、0.4mol/L、0.4mol/L,则当反应达到平衡时,各物质的浓度有可能是( )
A.c(X2)=0.4mol/LB.c(Y2)=0.2mol/L
C.c(Z)=0.6mol/LD.c(Y2)=0.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质结构的说法不正确的是
A.在NH3和PH3分子中键长:N-H>P-H
B.晶格能:NaF>NaCl>NaBr
C.CS2的填充模型:![]()
D.CH4和NH4+都是正四面体结构,键角均为109°28′
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法不正确的是
A.4.6gNa 与含 0.1molHCl 的稀盐酸充分反应,转移电子数目为 0.2 NA
B.质量为 3.0g 的 15N2 和 C18O 混合物中含有中子数为 1.6NA
C.常温常压下,1.12L 的 CO2 和 SO2 混合气体中,含有氧原子的数目小于 0.1NA
D.在 1L相同浓度的硫酸钾和硫酸铁混合液中K+浓度为 0.2 mol·Lˉ1,则溶液中 SO42—的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学--选修3 物质结构与性质)
二氧化碳和乙二醇在氧化锌或锌盐催化下可合成碳酸乙烯酯。
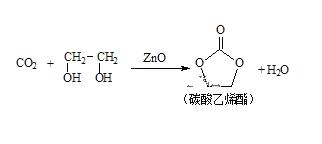
回答下列问题:
(1)锌基态离子的价电子排布式为_______________。
(2)乙二醇中C、H、O的电负性大小关系是__________;碳酸乙烯酯中碳原子的杂化轨道类型有___________;1mol碳酸乙烯酯中含有的σ键的数目为_______NA。
(3)锌盐水溶液中Zn2+可与H2O之间形成[Zn(H2O)6]2+,[Zn(H2O)6]2+中所含化学键的类型为____。
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为______。
(5)一种锌金合金晶体的立方体晶胞中,金原子位于顶点,锌原子位于面心,若该晶体的晶胞棱长为apm(1pm=10-12m),则该合金的密度为_______g·cm-3(用NA表示阿伏加德罗常数的值,列出算式不要求结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.含硫的煤燃烧时会产生SO2,对空气造成污染,且易形成酸雨。
(1)为了防治酸雨,工业上常用生石灰和含硫的煤混合后燃烧,燃烧时生成的SO2和生石灰、O2共同反应生成硫酸钙。请写出该反应的化学方程式___。
Ⅱ.沥青混凝土可作为反应;2CO(g)+O2(g)![]() 2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
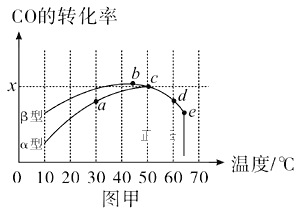
(2)a、b、c、d四点中,达到平衡状态的是__。
(3)已知c点时容器中O2浓度为0.02mol/L,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=__(用含x的代数式表示)。
(4)下列关于图甲的说法正确的是__。
A.CO转化反应的平衡常数K(a)<K(c)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高至一定温度后,催化剂失去活性
Ⅲ.活性炭还原法也是消除氮氧化物和硫氧化物的方法:某研究小组向某密闭容器中加入足量的活性炭和NO,发生反应:
C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=QkJ·mol-1
N2(g)+CO2(g) ΔH=QkJ·mol-1
在T1℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.40 | 0.20 | 0.30 | 0.60 | |
N2 | 0 | 0.40 | 0.60 | 0.60 | ||
CO2 | 0 | 0.60 | 0.60 |
(5)0~10min内,N2的平均反应速率v(N2)=__。
(6)若30min后升高温度至T2℃,重新达到平衡时,容器中NO、N2、CO2的浓度之比为7∶3∶3,则该反应的ΔH__0(填“>”、“=”、或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件己略去) ( )
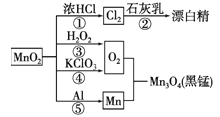
A. 只有反应①②④均属于氧化还原反应
B. 反应⑤说明该条件下铝可用于制熔点较高的金属
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
(1)该反应中,氧化剂是________,氧化产物是_____。
(2)当有3mol I2生成时,有______mol还原剂被氧化。
(3)当有1mol氧化剂参与反应时,转移电子的物质的量为_____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com