
| 2.33g |
| 233g/mol |
| ||
| 39.31 |
| 64 |
| 19.84 |
| 32 |
| 8.67 |
| 14 |
| ||
| ||


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
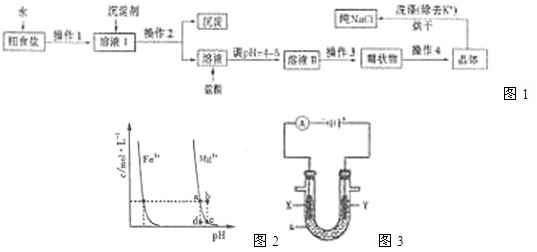
查看答案和解析>>
科目:高中化学 来源: 题型:
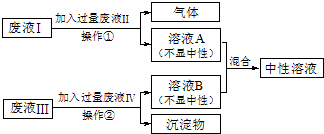
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量 | 0.390g | 0.702g | 0.936g |
| 标况下气体体积 | 448mL | 672mL | 672mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色.
如图是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色.查看答案和解析>>
科目:高中化学 来源: 题型:
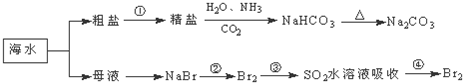
| A、在精盐制备纯碱时,一定要先通氨气到饱和,再通二氧化碳到饱和 |
| B、在第②步骤中,溴元素被氧化 |
| C、用氢氧化钡溶液可鉴别NaHCO3和Na2CO3 |
| D、制取NaHCO3的反应是利用其溶解度小于NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4 |
| B、CH3COOH |
| C、NaOH |
| D、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50 mL 0.5 mol/L的AlCl3溶液 |
| B、100 mL 2 mol/L的NaCl溶液 |
| C、1 L 0.2 mol/L的KCl溶液 |
| D、20 mL 0.5 mol/L的CaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com