
 如图是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色.
如图是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色.
| ||
| ||
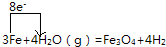 ,故答案为:
,故答案为: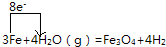 ;
;

 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
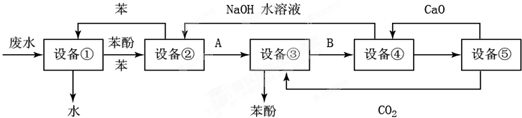
查看答案和解析>>
科目:高中化学 来源: 题型:
A、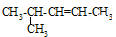 2-甲基-3-戊烯 |
B、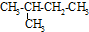 异丁烷 |
| C、CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
| D、CH3CH(NO2)CH2COOH 3-硝基丁酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴苯中的溴(NaOH溶液,分液) |
| B、乙酸乙酯中的乙醇(乙酸,分液) |
| C、苯中的苯酚(浓溴水,过滤) |
| D、乙醇中的乙酸(饱和Na2CO3溶液,分液) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓溴水、氯化铁溶液 |
| B、浓溴水、酸性高锰酸钾溶液 |
| C、浓溴水、碳酸钠溶液 |
| D、氯化铁溶液、酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、减小容器体积 | B、扩大容器体积 |
| C、加催化剂 | D、降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com