


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
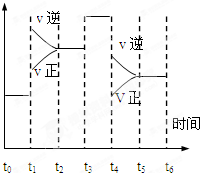 一密闭容器中发生下列反应:N2(g)+3H2(g)?2NH3(g);△H<0
一密闭容器中发生下列反应:N2(g)+3H2(g)?2NH3(g);△H<0查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| B、向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ |
| D、用CuCl2溶液做导电性实验,灯泡发光:CuCl2=Cu2++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
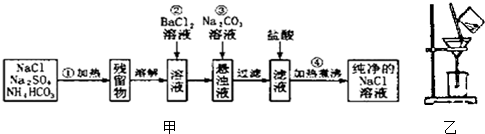
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
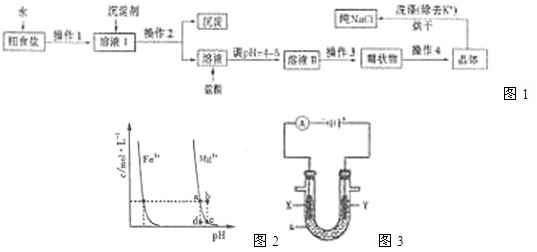
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀时的pH | 7.6 | 2.7 | 5.7 | 4.7 |
| 完全沉淀时的pH | 9.7 | 3.7 | 8.5 | 7.3 |

| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一种植物生长调节剂 |
| B、易燃 |
| C、能使溴水、酸性高锰酸钾溶液褪色 |
| D、与甲烷互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
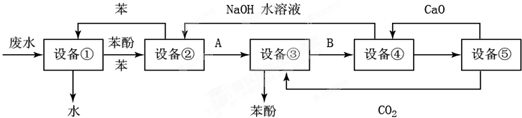
 如图是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色.
如图是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com