
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氢化法制备高铁酸钠,生产过程如下:
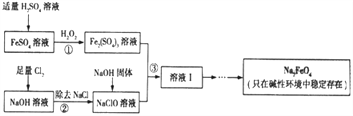
(1)高铁酸钠中铁元素的化合价为____________,次氯酸钠的电子式是__________________。
(2)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是__________________。
(3)步骤①反应的离子方程式是_________________________________。
(4)Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_________。(计算结果保留两位小数)
工业废水中常含有一定量的Cr2O![]() 易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O
易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O![]() 转化为Cr3+,再将Cr3+转化为沉淀。
转化为Cr3+,再将Cr3+转化为沉淀。
(5)利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理_____________________________________________。
(6)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为_________。
(7)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物。写出Cr(OH)3的酸式电离方程式______________。
(8)Cr3+在强碱溶液中可被双氧水氧化为CrO![]() ,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO
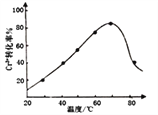
,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO![]() +8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
+8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
【答案】 +6 ![]()
![]()
![]() 0.64
0.64 ![]() 6
6 ![]() 或
或![]()
![]() 双氧水在较高温度下发生分解,浓度降低
双氧水在较高温度下发生分解,浓度降低
【解析】(1)钠元素的化合价为![]() 价,氧元素的化合价为
价,氧元素的化合价为![]() 价,根据化合价代数和为0,可得铁元素的化合价为
价,根据化合价代数和为0,可得铁元素的化合价为![]() 价;次氯酸钠属于离子化合物,由钠离子和次氯酸根离子组成,其电子式为
价;次氯酸钠属于离子化合物,由钠离子和次氯酸根离子组成,其电子式为![]() ;正确答案:+6 ;
;正确答案:+6 ;![]() 。
。
(2)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是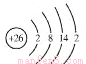 ;正确答案:
;正确答案: 。
。
(3)硫酸亚铁被双氧水氧化为硫酸铁,反应的离子方程式是:![]() ;正确答案:
;正确答案:![]() 。
。
(4)根据电子得失守恒规律可知:1molNa2FeO4中铁元素由+6价降低到+3价,得到3mol电子;1mol氯气由0价降低到-1价,得到2 mol电子;所以:设两种消毒剂的质量为1g,所以1gNa2FeO4得电子的量为1/166×3=0.018mol; 1g氯气得电子的量为1/71×2=0.028mol,所以Na2FeO4的消毒效率约是氯气的0.018/0.028=0.64 ;正确答案:0.64 。
(5)根据题给信息可知:SO2做还原剂,能够把Cr2O![]() 还原为Cr3+;离子方程式为:
还原为Cr3+;离子方程式为:![]() ;正确答案:
;正确答案:![]() 。
。
(7)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,Cr(OH)3的酸式电离方程式:![]() 或
或![]() ;正确答案:
;正确答案:![]() 或
或![]() 。
。
(6)根据Ksp[Cr(OH)3]=1×10-30=c(Cr3+)×c(OH-)3, c3(OH-)×1×10-6=1×10-30, c(OH-
(8)根据图像可知:![]() ,双氧水在较高温度下发生分解,浓度降低;正确答案:
,双氧水在较高温度下发生分解,浓度降低;正确答案:![]() ,双氧水在较高温度下发生分解,浓度降低。
,双氧水在较高温度下发生分解,浓度降低。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】合成神经抑制剂F的一种路线如图所示:
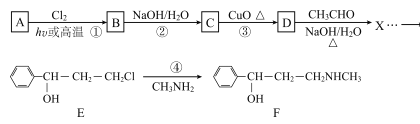
已知:![]()
请回答下列问题:
(1)已知芳香烃A的相对分子质量为92,A的结构简式为____;B的系统命名是___ ;C中含氧官能团的名称是____。
(2)反应③的化学反应方程式为____;①~④中属于取代反应的是____。
(3)D分子中最多有____个原子共平面。
(4)④的反应中,因反应温度控制不当,常常有副产物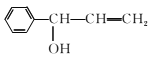 生成,写出可能的副反应方程式____。
生成,写出可能的副反应方程式____。
(5)包含C在内,C的同分异构体中芳香族化合物共有____种,其中满足下列条件同分异构体的结构简式为____。
①能使FeCl3溶液显色,②核磁共振氢谱上有4组峰,且峰面积之比为3:2:2:1。
(6)已知-CHO与RNH2易发生反应,现以中间体X为原料,设计出制备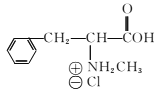 的合成路线(无机试剂自选):________________________________________
的合成路线(无机试剂自选):________________________________________
流程示例:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组根据镁与CO2的反应设计实验探究镁与NO2的反应。
甲同学推测产物是MgO和N2;
乙同学推测产物除了MgO和N2外,固体中还可能含有Y。
该小组同学设计了以下装置探究镁与NO2反应的固体产物,并测定其组成。

(1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃管充满红综色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯。这样做的目的是___________________________________________________________
(2)装置B中的试剂可以选用________
A、浓硫酸 B、无水氯化钙 C、五氧化二磷 D、碱石灰
(3)装置C中盛装氢氧化钠溶液的作用是:___________________________________
(4)为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是①气体恢复至室温再读数;②_______________________________;③______________________________。
(5)实验结束后,同学们将固体产物取出与水反应,发现有刺激性气味的气体产生,该气体能使湿润的石蕊试纸变蓝。说明乙组同学推测正确,请写出Y与水反应的化学方程式__________________________________
(6)若初始加入镁粉质量为3.6 g,在足量的NO2中充分反应后 ,收集到N2体积为448mL (标准状况),则产物中MgO的质量是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量C及SiO2)为原料制备的流程如下:
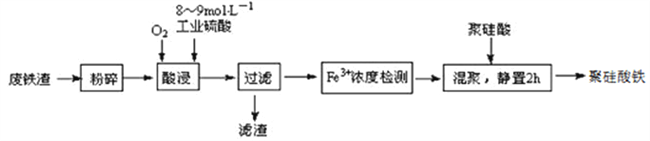
已知:在一定温度下酸浸时Fe3+在pH=2开始沉淀,pH=3.7沉淀完全
(1)废铁渣进行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如下表所示:
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式__________________________________。
②硫酸酸浸时应控制溶液的pH____________,其原因是_________________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________________。
(3)上述过滤步骤的滤液的主要成分为____________(填化学式)。
(4)Fe3+浓度定量检则,是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.聚甲基丙烯酸甲酯(PMMA)俗称有机玻璃。其结构简式为: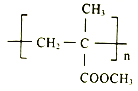 。以下是有机玻璃的一种合成路线:
。以下是有机玻璃的一种合成路线:
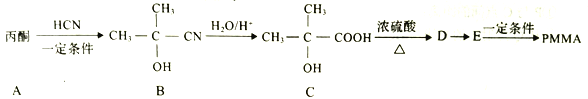
回答下列问题:
(1)A的结构简式为________,A生成B的反应类型是______反应。
(2)C中官能团的名称是________ ,D的名称是________(系统命名法)。
(3)由E生成PMMA的化学方程式为____________。
II.由合成PMMA得到的启示,可应用于由苯酚为主要原料制备![]()
(4)![]() 的同分异构体中符合下列条件的有_____种(不考虑立体异构):
的同分异构体中符合下列条件的有_____种(不考虑立体异构):
①属于![]() 的二取代物
的二取代物
②取代基处于对位且完全相同
③能够与NaHCO3溶液反应产生CO2
其中核磁共振氢谱有5个峰,峰面积之比为6:2:1:1的是_________(填结构简式)。
(5)参照I中有机玻璃的合成路线,设计并完善![]() 的合成路线:
的合成路线:
 ____________
____________![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、下表是某研究性学习小组探究稀硫酸与金属锌反应的实验数据:

实验数据可发现有一个数据明显有错误,该数据是实验________(填实验序号),理由是_______________________________________________
Ⅱ、在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0
2SO3(g) △H<0
(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是___________。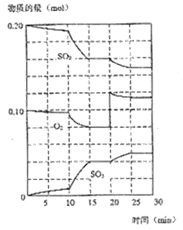
(2)据图判断,反应进行至20min时,曲线发生变化的原因是__________(用文字表达);10min到15min的曲线变化的原因可能是_____________(填写编号)。
A. 加了催化剂 B. 缩小容器体积
C. 降低温度 D. 增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的下列性质能肯定该物质为离子化合物的是( )
A.水溶液能导电的化合物
B.由金属元素和非金属元素组成的化合物
C.在熔化状态下能导电的化合物
D.熔点高的物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com