
����Ŀ���⻯�ƹ����ǵ�ɽ�˶�Ա���õ���Դ�ṩ����ij��ȤС����ѡ������װ���Ʊ��⻯�ƣ� 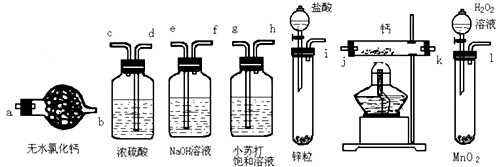
��ش��������⣺
��1����ѡ���Ҫ��װ�ã���������������˳��Ϊ���������ӿڵ���ĸ��ţ���
��2������������ʵ��װ�ý���ʵ�飬ʵ�鲽�����£����װ�������Ժ�װ��ҩƷ����Һ©�����������밴��ȷ��˳���������в���ı�ţ���
A.���ȷ�Ӧһ��ʱ��
B.�ռ����岢�����䴿��
C.�رշ�Һ©������
D.ֹͣ���ȣ������ȴ
��3��ʵ�������ijͬѧȡ�������С�ļ���ˮ�У��۲쵽������ð������Һ�м����̪���Ժ�ɫ����ͬѧ�ݴ��ƶϣ�����ʵ��ȷ��CaH2���ɣ� ��д��CaH2��ˮ��Ӧ�Ļ�ѧ����ʽ��
�ڸ�ͬѧ���жϲ���ȷ��ԭ���ǣ�����ػ�ѧ����ʽ��ʾ�� ��
���𰸡�
��1��iefabjk����k��j��d
��2��ABCD
��3��CaH2+2H2O=Ca��OH��2+2H2����Ca+2H2O�TCa��OH��2+H2��
���������⣺��1�������ڼ����õĽ�����������ˮ��Ӧ�����������ƺ����������Ʊ��������л����ˮ�������Ȼ��⣬��������ƻ���֮ǰ��Ҫ���Ӻ���ֱ�ѡ���Լ����������ƺ�Ũ���ͬʱΪ��ֹ������ˮ�������룬�����Ҫ���Ӹ���ܣ�������ȷ��˳��Ϊ��ief ab j k����k��j��d�����Դ��ǣ�ief ab j k����k��j��d����2�����ڶ����������Ҫȼ�շ�Ӧ��������Ӧ�����ռ�һ�������岢�����䴿�ȣ���Ӧ��������Ҫʹ�⻯���������ķ�Χ����ȴ������Ӧ�����رշ�Һ©�������������ȷ��˳��ΪBADC�����Դ��ǣ�BADC����3��CaH2��Ca��ˮ��Ӧ���ܲ���Ca��OH��2��H2 �� ��Ӧ����ʽ�ֱ�Ϊ��CaH2+2H2O=Ca��OH��2+2H2����Ca+2H2O=Ca��OH��2+H2������˲��ܸ��ݷ�Ӧ����Һ�ʼ����ж��Ƿ���CaH2 �� ���Դ��ǣ�CaH2+2H2O=Ca��OH��2+2H2����Ca+2H2O�TCa��OH��2+H2����


 ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д� һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д� ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������������Һ�д���������ǣ�������
A. Ag+��K+��NO3����Cl�� B. Mg2+��Na+��Cl����SO42��
C. Ca2+��Mg2+��OH����Cl�� D. H+��Na+��CO32����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��FΪԭ��������������Ķ���������Ԫ�أ�A��Fԭ�ӵ�����������������������������Fԭ�ӵĵ��Ӳ�����A��3����Bԭ�Ӻ�����ӷִ�3����ͬ�ܼ���ÿ���ܼ��ϵĵ�������ͬ��A��C�γɵķ���Ϊ�����Σ�Dԭ��p����ϳɶԵĵ�����������δ�ɶԵĵ���������Eԭ�Ӻ���ÿ��ԭ�ӹ���ϵĵ��Ӷ��ѳɶԣ�E�縺��С��F��
��1��A��C�γɵķ��Ӽ�������ˮ����÷��ӻ�Ϊ�ȵ������������Ϊ ��
��2���Ƚ�E��F�ĵ�һ�����ܣ�E�������������F��
��3��BD2�ڸ��¸�ѹ�����γɵľ�����ͼ��ʾ���þ������������������ӡ���ԭ�ӡ������ӡ������������壬�þ�����Bԭ�ӵ��ӻ���ʽΪ �� 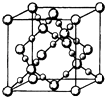
��4������F��ǿ����Һ��Ӧ��[F��OH��4]�����ɣ���[F��OH��4]���д���������ĸ���� a�����ۼ� b���Ǽ��Լ� c����λ�� d���Ҽ� e���м�
��5��Cu���������������壬�������ÿ����5��Cuԭ�ӽ��ܶ�������֪ÿ��Cuԭ�ӵ�����Ϊa g��Cuԭ�Ӱ뾶Ϊd cm����þ�����ܶ�Ϊgcm��3 �� ���ú�a��d�Ĵ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ��������pHֵ����7���ǣ� ��
A.NH4Cl
B.H3PO4
C.NaHCO3
D.Na2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3��HNO3����Ҫ�Ĺ�ҵ��Ʒ����ͼΪ�ϳɰ��Լ�����������������̡�
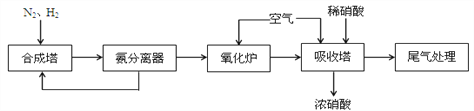
��1���ϳ����з�����Ӧ�Ļ�ѧ����ʽ��_______________________________
�Ӱ����������ֻص��ϳ����е�������_________________��
��2������¯�з�����Ӧ�Ļ�ѧ����ʽ��_________________________________________
��3��β���е�����NO��NO2������NH3���������ڴ�����������������Ⱦ������,д��NO2�� NH3��Ӧ�Ļ�ѧ����ʽ__________________________________________________
����5.6L NO2����ԭʱ,ת�Ƶ��ӵ����ʵ���Ϊ ________________mol.
��4������¯�г���������,�Ƚ����ٽ���������,��������ͨ�������������_________________.��������������������������ΪNO210.0%,NO 1.32%,����ΪN2��ˮ������.������������������Ϊ10m3ʱ,������Ҫ���������Ϊ_____________m3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ������Ȼ�þ�Ļ�����У������ӵ����ʵ���֮��Ϊ1:2�����������������ʵ�����֮�ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�1mol��ѧ���ֽ����̬ԭ������Ҫ��������E��ʾ����ϱ�����Ϣ�ж�����˵������ȷ���ǣ� ��
���ۼ� | H��H | F��F | H��F | H��Cl | H��I |
E(kJ��mol1) | 436 | 157 | 568 | 432 | 298 |
A. �������ȶ��Ĺ��ۼ���H��F
B. 1mol H2(g)��1mol F2(g)����2molHF(g)�ų�25kJ������
C. 432kJ��mol1��E(H��Br)��298kJ��mol1
D. 1mol H2(g)�ֽ��2mol H(g) ������436kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������������һ�����ҵĻ���������������ҵ��������������д��ڷ�Ӧ��2SO2��g��+O2��g��2SO3��g������Ӧ��ϵ��SO3�İٷֺ������¶ȵĹ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺
��1��������ԭ�ӵĽṹʾ��ͼ
��2������˵����ȷ����a�����ں��¡���ѹ������������ƽ����ϵ��ͨ�뺤����ƽ�ⲻ�ƶ�
b����D��ʱ��v����v��
c��B�㡢C�㷴Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2 �� ��K1��K2
d����A��ʱ������1mol SO2�ض�ͬʱ����1mol SO3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Һ�����ܸ�пƬ��Ӧ�����������Ӧ����������( )
A.10�� 20mL 3mol/L��������ҺB.20�� 10mL 4mol/L��������Һ
C.20�� 20mL 2mol/L��������ҺD.20�� 30mL 2mol/L��������Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com