
����Ŀ��A��B��C��D��E��FΪԭ��������������Ķ���������Ԫ�أ�A��Fԭ�ӵ�����������������������������Fԭ�ӵĵ��Ӳ�����A��3����Bԭ�Ӻ�����ӷִ�3����ͬ�ܼ���ÿ���ܼ��ϵĵ�������ͬ��A��C�γɵķ���Ϊ�����Σ�Dԭ��p����ϳɶԵĵ�����������δ�ɶԵĵ���������Eԭ�Ӻ���ÿ��ԭ�ӹ���ϵĵ��Ӷ��ѳɶԣ�E�縺��С��F��
��1��A��C�γɵķ��Ӽ�������ˮ����÷��ӻ�Ϊ�ȵ������������Ϊ ��
��2���Ƚ�E��F�ĵ�һ�����ܣ�E�������������F��
��3��BD2�ڸ��¸�ѹ�����γɵľ�����ͼ��ʾ���þ������������������ӡ���ԭ�ӡ������ӡ������������壬�þ�����Bԭ�ӵ��ӻ���ʽΪ �� 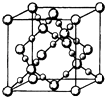
��4������F��ǿ����Һ��Ӧ��[F��OH��4]�����ɣ���[F��OH��4]���д���������ĸ���� a�����ۼ� b���Ǽ��Լ� c����λ�� d���Ҽ� e���м�
��5��Cu���������������壬�������ÿ����5��Cuԭ�ӽ��ܶ�������֪ÿ��Cuԭ�ӵ�����Ϊa g��Cuԭ�Ӱ뾶Ϊd cm����þ�����ܶ�Ϊgcm��3 �� ���ú�a��d�Ĵ���ʽ��ʾ��
���𰸡�
��1��H3O+
��2����
��3��ԭ�Ӿ��壻sp3
��4��acd
��5��![]()
���������⣺A��B��C��D��E��FΪԭ��������������Ķ���������Ԫ�أ�A��Fԭ�ӵ�����������������������������Fԭ�ӵĵ��Ӳ�����A��3������AΪ��Ԫ�أ�FΪ��Ԫ�أ�Bԭ�Ӻ�����ӷִ�3����ͬ�ܼ���ÿ���ܼ��ϵĵ�������ͬ����B�ĺ�������Ų�Ϊ1s22s22p2 �� BΪ̼Ԫ�أ�A��C�γɵķ���Ϊ�����Σ���C��ԭ����������B��F֮�䣬����CΪ��Ԫ�أ�Dԭ��p����ϳɶԵĵ�����������δ�ɶԵĵ�����������p�������4�����ӣ�����D��ԭ������С��F������D�ĺ�������Ų�Ϊ1s22s22p4 �� ����DΪ��Ԫ�أ�Eԭ�Ӻ���ÿ��ԭ�ӹ���ϵĵ��Ӷ��ѳɶԣ�E�縺��С��F����ԭ������С��F������EΪþԪ�أ���1��A��C�γɵķ��Ӽ�������ˮ�������ʽΪNH3 �� ���ݵȵ�����ԭ�����۵��Ӻ�ԭ����Ҫ�ֱ���ȣ�����д�����以Ϊ�ȵ������������Ϊ��H3O+ �� ���Դ��ǣ�H3O+����2��Mg��AlԪ�ض��ǵڶ����ڽ���Ԫ�أ�ͬһ����Ԫ��������ҵ�һ�����ܳ��������ƣ���MgԪ��ԭ��3S�ܼ��dz���״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ����Ե�һ������Mg��Al�����Դ��ǣ�������3������CO2�ڸ��¸�ѹ�����γɵľ����Ľṹͼ��֪���þ�������̼ԭ������ԭ��ֱ�ӹ��ɣ�̼ԭ������ԭ��֮��ͨ�����ۼ����ã��������־���Ϊԭ�Ӿ��壬ÿ��̼ԭ����Χ�����ĸ�C��O��������Cԭ�ӵĹ���ӻ���ʽΪsp3 �� ���Դ��ǣ�ԭ�Ӿ��壬sp3����4����[Al��OH��4]���У�������������������֮������λ�����ã����������ڲ������ż��Թ��ۼ�����Щ���ۼ����ǵ�����Ҳ���Ƕ��ǦҼ����ݴ��ж�acd��ȷ�����Դ��ǣ�acd����5��ͭ��������������������ÿ��ͭ�����к��е�ԭ�Ӹ���=8�� ![]() +6��
+6�� ![]() =4���������ÿ����5��Cuԭ�ӽ��ܶ�����Cu��ԭ�Ӱ뾶Ϊd cm���������������Խ��߳���Ϊ4dcm�����Ծ����ı߳�Ϊ
=4���������ÿ����5��Cuԭ�ӽ��ܶ�����Cu��ԭ�Ӱ뾶Ϊd cm���������������Խ��߳���Ϊ4dcm�����Ծ����ı߳�Ϊ ![]() ��4dcm=
��4dcm= ![]() dcm�����Ծ�����ܶ�
dcm�����Ծ�����ܶ� ![]() g/cm3=
g/cm3= ![]() g/cm3 �� ���Դ��ǣ�
g/cm3 �� ���Դ��ǣ� ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.���ڿ�����ȼ�����ɵ���ɫ��Na2O2
B.��SO2ͨ�����BaCl2��Һ������BaSO3����
C.������ˮ�����ԣ������еμ�������ɫʯ����Һ������Һ���ճʺ�ɫ
D.��ȼ��þ������ʢ��CO2�ļ���ƿ�У�����Ϩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڷ�Ӧ�����������仯��˵����ȷ���ǣ� ��
A.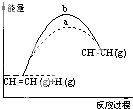 ͼ��a��b���߿ɷֱ��ʾ��ӦCH2=CH2��g��+H2��g����CH3CH3��g����H��0ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
ͼ��a��b���߿ɷֱ��ʾ��ӦCH2=CH2��g��+H2��g����CH3CH3��g����H��0ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
B.��֪2C��s��+2O2��g��=2CO2��g����H1��2C��s��+O2��g��=2CO��g����H2 �� ���H1����H2
C.ͬ��ͬѹ�£���ӦH2��g��+Cl2��g��=2HCl��g���ڹ��պ͵�ȼ�����µġ�H��ͬ
D.��һ�������£�ij���淴Ӧ�ġ�H=+100kJmol��1 �� ��÷�Ӧ����Ӧ��ܱ��淴Ӧ��ܴ�100kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������ԭ�ӣ������γɵ�������
A.L��6��B.L��4��C.M��2��D.M��7��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϵ�ⷨ�����������Է�ˮ���õ�����Ni��ԭ����ͼ��ʾ������˵������ȷ���ǣ� �� ��֪����Ni2+����������Һ�з���ˮ�� �������ԣ�Ni2+����Ũ�ȣ���H+��Ni2+����Ũ�ȣ�
A.̼���Ϸ����ĵ缫��Ӧ��4OH����4e���TO2��+2H2O
B.�������У�B��NaCl��Һ�����ʵ���Ũ�Ƚ����ϼ���
C.Ϊ�����Ni�IJ��ʣ�����������Ҫ���Ʒ�ˮpH
D.����ͼ��������Ĥȥ������A��B���Һϲ������ⷴӦ�ܷ���ʽ�����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڼ����������ܹ��ֽ��һ���������������÷�Ӧ���е�45sʱ���ﵽƽ�⣨NO2Ũ��ԼΪ0.0125molL��1������ͼ�е����߱�ʾ���������ֽⷴӦ��ǰ25s�ڵķ�Ӧ���̣� 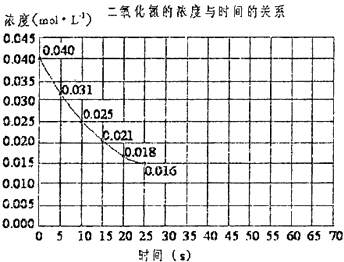
��1��д����Ӧ�Ļ�ѧ����ʽ ��
��2����10s�������ķ�Ӧ���� ��
��3������Ӧ������70s������ͼ����ʵ����25s��70s�ķ�Ӧ�������ߣ�
��4�����ڷ�Ӧ��ʼʱ����������������������䣩������ͼ�����������Ӵ����ķ�Ӧ�������ߣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯�ƹ����ǵ�ɽ�˶�Ա���õ���Դ�ṩ����ij��ȤС����ѡ������װ���Ʊ��⻯�ƣ� 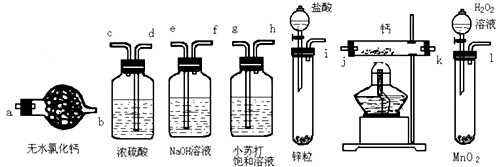
��ش��������⣺
��1����ѡ���Ҫ��װ�ã���������������˳��Ϊ���������ӿڵ���ĸ��ţ���
��2������������ʵ��װ�ý���ʵ�飬ʵ�鲽�����£����װ�������Ժ�װ��ҩƷ����Һ©�����������밴��ȷ��˳���������в���ı�ţ���
A.���ȷ�Ӧһ��ʱ��
B.�ռ����岢�����䴿��
C.�رշ�Һ©������
D.ֹͣ���ȣ������ȴ
��3��ʵ�������ijͬѧȡ�������С�ļ���ˮ�У��۲쵽������ð������Һ�м����̪���Ժ�ɫ����ͬѧ�ݴ��ƶϣ�����ʵ��ȷ��CaH2���ɣ� ��д��CaH2��ˮ��Ӧ�Ļ�ѧ����ʽ��
�ڸ�ͬѧ���жϲ���ȷ��ԭ���ǣ�����ػ�ѧ����ʽ��ʾ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Һ̬HCl��NaCl��Һ��˵����������
A.HCl�Ĺ��ۼ����ƻ�B.NaCl�����Ӽ����ƻ�
C.HCl��NaCl�Ļ�ѧ�������ƻ�D.HCl��NaCl�Ļ�ѧ����δ���ƻ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com