
【题目】下列叙述正确的是( )
A.钠在空气中燃烧生成淡黄色的Na2O2
B.将SO2通入过量BaCl2溶液可生成BaSO3沉淀
C.新制氯水显酸性,向其中滴加少量紫色石蕊试液,振荡后溶液最终呈红色
D.点燃的镁条插入盛有CO2的集气瓶中,立即熄灭
【答案】A
【解析】解:A、钠在空气中燃烧生成的不是氧化钠,而是过氧化钠:2Na+O2 ![]() Na2O2 , Na2O2是淡黄色的固体,故A正确; B、强酸能制弱酸,而弱酸不能制出强酸.由于酸性H2SO3<HCl,故SO2不能和BaCl2反应制出HCl,即SO2不能和BaCl2反应,故B错误;
Na2O2 , Na2O2是淡黄色的固体,故A正确; B、强酸能制弱酸,而弱酸不能制出强酸.由于酸性H2SO3<HCl,故SO2不能和BaCl2反应制出HCl,即SO2不能和BaCl2反应,故B错误;
C、新制氯水中含HCl、HClO和未完全反应完的Cl2 , 导致氯水有酸性、强氧化性、漂白性和不稳定性.故向其中滴加少量紫色石蕊试液,振荡后溶液先变红色后褪色,体现氯水的酸性和漂白性,故C错误;
D、镁条能在CO2中燃烧生成氧化镁和碳:2Mg+O2 ![]() 2MgO+C,故镁条不会熄灭,从此也可看出,不能用CO2来灭镁火,故D错误;
2MgO+C,故镁条不会熄灭,从此也可看出,不能用CO2来灭镁火,故D错误;
故选A.
【考点精析】根据题目的已知条件,利用氯气的化学性质和钠的化学性质的相关知识可以得到问题的答案,需要掌握氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应;钠的化学性质:与非金属反应;与水反应;与酸反应;与盐溶液反应.


科目:高中化学 来源: 题型:
【题目】成环是有机合成的重要环节.如反应①化合物(Ⅰ)可由(Ⅲ)合成: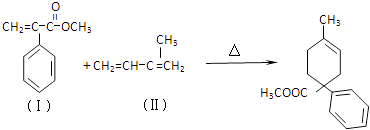
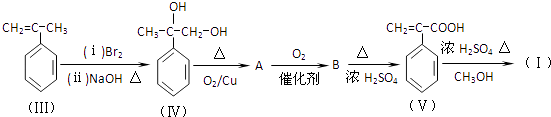
(1)(Ⅰ)的分子式为 , 1mol(Ⅰ)最多能与molH2发生加成反应.
(2)写出(Ⅳ)→A的化学方程式 .
(3)酸性条件下,化合物B能发生聚合反应,化学方程式为 .
(4)化合物B→(Ⅴ)的反应类型为 .
(5)(Ⅲ)与(Ⅱ)也能发生类似反应①的反应,生成含两个六元环的化合物的结构简式为(任写一种)
(6)下列物质与(Ⅴ)互为同分异构体的是(填序号)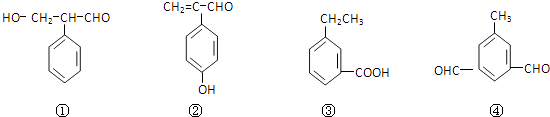
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天津港爆炸致大量氰化钠(NaCN)泄露,NaCN是剧毒物质.专家们使用双氧水(H2O2)来处理氰化钠,反应方程式如下:H2O2+NaCN+H2O═NaHCO3+NH3
(1)若有0.49吨 NaCN泄露至少需要质量分数为34%的H2O2溶液吨进行处理 (假设H2O2的处理效果是100%,且不考虑H2O2自身分解)
(2)相比于双氧水,漂白粉(主要成分Ca(ClO)2)的价格要便宜的多,若处理相同质量的NaCN(生成物相同)需要消耗Ca(ClO)2mol(假设Ca(ClO)2的处理效果是100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1molC﹣H键,要吸收热量414.4kJ;断裂1mol C﹣C键,要吸收热量347.4kJ;生成1mol C═C键,会放出热量615.3kJ;生成1mol H﹣H键,会放出热量435.3kJ,某有机物分解的反应可表示为: 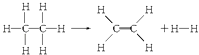
若在反应中消耗了1mol乙烷(反应物),则有关该反应的说法正确的是( )
A.该反应放出251.2 kJ的热量
B.该反应吸收251.2 kJ的热量
C.该反应放出125.6 kJ的热量
D.该反应吸收125.6 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列离子浓度关系或结论正确的是( )
A.将0.1mol/L氨水与0.1 mol/L稀盐酸等体积混合:c(NH ![]() )>c(Cl﹣)>c(H+)>c(OH﹣)
)>c(Cl﹣)>c(H+)>c(OH﹣)
B.将pH=2 的稀盐酸与pH=12的氨水等体积混合,所得溶液pH>7
C.0.10 mol?L﹣1的氨水用HNO3溶液完全中和后,溶液显中性
D.用惰性电极电解稀硫酸时,实质是电解水,溶液的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关铜与浓硫酸的反应下列说法错误的是
A. 该反应中氧化剂与还原剂物质的量之比为1:1
B. 浓硫酸在反应中既体现出氧化性,又体现出酸性
C. 标准状况下,lmol铜和2mol浓硫酸充分反应可得22.4L气体
D. 1mol铜和足量浓硫酸反应,转移电子个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是( )
A. Ag+、K+、NO3﹣、Cl﹣ B. Mg2+、Na+、Cl﹣、SO42﹣
C. Ca2+、Mg2+、OH﹣、Cl﹣ D. H+、Na+、CO32﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E,F为原子序数依次增大的短周期主族元素.A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级且每个能级上的电子数相同;A与C形成的分子为三角锥形;D原子p轨道上成对的电子总数等于未成对的电子总数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F.
(1)A,C形成的分子极易溶于水,与该分子互为等电子体的阳离子为 .
(2)比较E、F的第一电离能:E(填“>”或“<”)F.
(3)BD2在高温高压下所形成的晶胞如图所示.该晶体的类型属于(填“分子”“原子”“离子”或“金属”)晶体,该晶体中B原子的杂化形式为 . 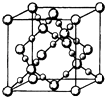
(4)单质F与强碱溶液反应有[F(OH)4]﹣生成,则[F(OH)4]﹣中存在(填字母). a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
(5)Cu晶体是面心立方体,立方体的每个面5个Cu原子紧密堆砌,已知每个Cu原子的质量为a g,Cu原子半径为d cm,求该晶体的密度为gcm﹣3 . (用含a、d的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com