
【题目】常温下,下列离子浓度关系或结论正确的是( )
A.将0.1mol/L氨水与0.1 mol/L稀盐酸等体积混合:c(NH ![]() )>c(Cl﹣)>c(H+)>c(OH﹣)
)>c(Cl﹣)>c(H+)>c(OH﹣)
B.将pH=2 的稀盐酸与pH=12的氨水等体积混合,所得溶液pH>7
C.0.10 mol?L﹣1的氨水用HNO3溶液完全中和后,溶液显中性
D.用惰性电极电解稀硫酸时,实质是电解水,溶液的pH不变
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】等物质的量的CO2和NH3相比,下列说法不正确的是
A. 常温常压下,体积之比为1:1 B. 分子数之比为1:1
C. 原子数之比为1:1 D. 质量之比为44:17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图1所示. 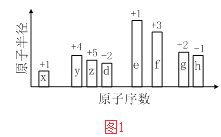
根据判断出的元素回答问题:
(1)f在元素周期表的位置是 .
(2)比较d、e常见离子的半径的小(用化学式表示,下同)>;比较g、h的最高价氧化物对应的水化物的酸性强弱是:> .
(3)任选上述元素组成一种四原子共价化合物,写出其电子式 .
(4)已知1mol 单质e在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式: .
(5)上述元素可组成盐R:zx4f(gd4)2 , 向盛有10mL1molL1R溶液的烧杯中滴加1molL1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图2如下: 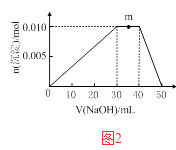
①写出m点反应的离子方程式 .
②若R溶液改加20mL1.2molL1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500﹣600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁.现用如图所示的装置模拟上述过程进行试验.回答下列问题: 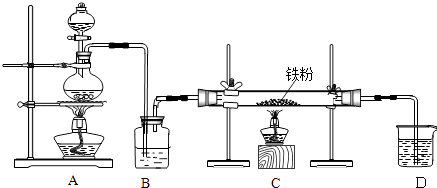
(1)制取无水氯化铁的实验中,A中反应的化学方程式为 , 装置B中加入的试剂是 .
(2)制取无水氯化亚铁的实验中,装置A用来制取 . 尾气的成分是 . 若仍用D的装置进行尾气处理,存在的问题是、 .
(3)若操作不当,制得的FeCl2 会含有少量FeCl3 , 检验FeCl3常用的试剂是 . 欲制得纯净的FeCl2 , 在实验操作中应先点燃处的酒精灯,目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.钠在空气中燃烧生成淡黄色的Na2O2
B.将SO2通入过量BaCl2溶液可生成BaSO3沉淀
C.新制氯水显酸性,向其中滴加少量紫色石蕊试液,振荡后溶液最终呈红色
D.点燃的镁条插入盛有CO2的集气瓶中,立即熄灭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绝大多数原子核是由质子和中子构成的,如果质子或中子为某些特定数值,原子核就异常稳定,科学家将这些数值称为“幻数”,科学家在人造硅同位素![]() Si中发现新的物理学“幻数”,下列有关
Si中发现新的物理学“幻数”,下列有关![]() Si的说法不正确的是( )
Si的说法不正确的是( )
A. ![]() Si原子核内含有14个质子 B.
Si原子核内含有14个质子 B. ![]() Si的原子序数为14
Si的原子序数为14
C. ![]() Si的核外电子数为14 D.
Si的核外电子数为14 D. ![]() Si原子核内含有42个中子
Si原子核内含有42个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中可能大量共存的离子组是( )
A.加入金属镁能产生H2的溶液中:Na+、Fe2+、SO ![]() 、NO
、NO ![]()
B.含有大量Fe2+的溶液中:K+、Mg2+、ClO﹣、SO ![]()
C.能使Al3+生成沉淀的溶液中:NH4+、Na+、SiO ![]() 、HCO3﹣
、HCO3﹣
D.水电离产生的c(OH﹣)=1×10﹣10mol/L的溶液中:Al3+、SO ![]() 、NO
、NO ![]() 、Cl﹣
、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( ) 已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH﹣﹣4e﹣═O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A,B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com