
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图1所示. 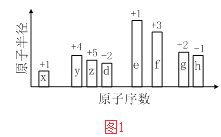
根据判断出的元素回答问题:
(1)f在元素周期表的位置是 .
(2)比较d、e常见离子的半径的小(用化学式表示,下同)>;比较g、h的最高价氧化物对应的水化物的酸性强弱是:> .
(3)任选上述元素组成一种四原子共价化合物,写出其电子式 .
(4)已知1mol 单质e在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式: .
(5)上述元素可组成盐R:zx4f(gd4)2 , 向盛有10mL1molL1R溶液的烧杯中滴加1molL1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图2如下: 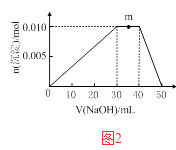
①写出m点反应的离子方程式 .
②若R溶液改加20mL1.2molL1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为mol.
【答案】
(1)第三周期ⅢA族
(2)O2﹣;Na+;HClO4;H2SO4
(3)![]() (或
(或 ![]()
![]() )
)
(4)2Na(s)+O2(g)=Na2O2(s)△H=﹣511kJ?mol﹣1
(5)NH4++OH﹣=NH3?H2O;0.022
【解析】解:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族,所以答案是:第三周期ⅢA族;(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(O2﹣)>r(Na+);非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4 , 所以答案是:r(O2﹣)>r(Na+);HClO4;H2SO4;(3)四原子共价化合物,可以是NH3、H2O2、C2H2等,其电子式为: ![]() (或
(或 ![]()
![]() ),所以答案是:
),所以答案是: ![]() (或
(或 ![]()
![]() );(4)1molNa的单质在足量O2中燃烧生成Na2O2(s),放出255.5kJ热量,2molNa反应放出热量为511kJ,则该反应的热化学方程式为:2Na(s)+O2(g)=Na2O2(s)△H=﹣511kJmol﹣1 , 所以答案是:2Na(s)+O2(g)=Na2O2(s)△H=﹣511kJmol﹣1;(5)①R是NH4Al(SO4)2 , m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH﹣反应生成NH3H2O,离子方程式为:NH4++OH﹣=NH3H2O, 所以答案是:NH4++OH﹣=NH3H2O;③10mL 1molL﹣1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42﹣的物质的量为0.02mol,20mL 1.2 molL﹣1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH﹣为0.048mol,由SO42﹣+Ba2+=BaSO4↓,可知SO42﹣不足,故可以得到0.02mol BaSO4 ,
);(4)1molNa的单质在足量O2中燃烧生成Na2O2(s),放出255.5kJ热量,2molNa反应放出热量为511kJ,则该反应的热化学方程式为:2Na(s)+O2(g)=Na2O2(s)△H=﹣511kJmol﹣1 , 所以答案是:2Na(s)+O2(g)=Na2O2(s)△H=﹣511kJmol﹣1;(5)①R是NH4Al(SO4)2 , m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH﹣反应生成NH3H2O,离子方程式为:NH4++OH﹣=NH3H2O, 所以答案是:NH4++OH﹣=NH3H2O;③10mL 1molL﹣1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42﹣的物质的量为0.02mol,20mL 1.2 molL﹣1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH﹣为0.048mol,由SO42﹣+Ba2+=BaSO4↓,可知SO42﹣不足,故可以得到0.02mol BaSO4 ,
Al3++3OH﹣=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH﹣为0.048mol﹣0.03mol=0.018mol,
NH4++OH﹣=NH3H2O
0.01mol 0.01mol
反应剩余OH﹣为0.018mol﹣0.01mol=0.008mol,
Al(OH)3+OH﹣=AlO2﹣+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol﹣0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
所以答案是:0.022.


科目:高中化学 来源: 题型:
【题目】在平板电视显示屏生产过程中产生的大量废玻璃粉末中含有二氧化铈(CeO2).
(1)①煅烧Ce(OH)CO3可制备CeO2 , 配平该反应的化学方程式Ce(OH)CO3+O2=CeO2+CO2+H2O
②已知在一定条件下,电解熔融状态的CeO2可制备Ce,在阴极获得铈,写出阴极的电极反应式;
(2)某课题组以上述废玻璃粉末(含有SiO2、Fe2O3、CeO2以及其他少量不溶于稀酸的物质)为原料,设计如图1流程对资源进行回收,得到Ce(OH)4和硫酸铁铵.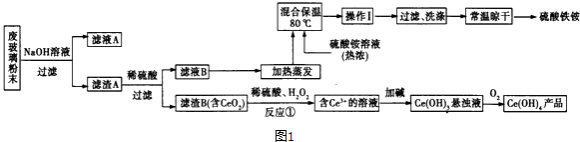
①得到滤渣B时,需要将其表面杂质洗涤干净.检验滤渣B已经洗涤干净的方法是 .
②反应①的离子方程式为 .
③如图2,氧化还原滴定法测定制得的Ce(OH)4产品的纯度.
该产品中Ce(OH)4的质量分数为(保留小数点后两位).若滴定所用FeSO4溶液已在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度(“偏高”、“偏低”或“无影响”).
(3)操作I的名称是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+O2(g)→2H2O(g)+483.6kJ.下列说法或表达正确的是( )
A.在相同的条件下,2mol氢气与1 mol氧气的总能量小于2mol 水蒸气的总能量
B.H2(g)+ ![]() ?O2(g)→H2O(1)+Q1;Q1>241.8kJ
?O2(g)→H2O(1)+Q1;Q1>241.8kJ
C.氢气燃烧是放热反应,所以氢气和氧气反应不需要其他外界条件即可发生
D.任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天津港爆炸致大量氰化钠(NaCN)泄露,NaCN是剧毒物质.专家们使用双氧水(H2O2)来处理氰化钠,反应方程式如下:H2O2+NaCN+H2O═NaHCO3+NH3
(1)若有0.49吨 NaCN泄露至少需要质量分数为34%的H2O2溶液吨进行处理 (假设H2O2的处理效果是100%,且不考虑H2O2自身分解)
(2)相比于双氧水,漂白粉(主要成分Ca(ClO)2)的价格要便宜的多,若处理相同质量的NaCN(生成物相同)需要消耗Ca(ClO)2mol(假设Ca(ClO)2的处理效果是100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列离子浓度关系或结论正确的是( )
A.将0.1mol/L氨水与0.1 mol/L稀盐酸等体积混合:c(NH ![]() )>c(Cl﹣)>c(H+)>c(OH﹣)
)>c(Cl﹣)>c(H+)>c(OH﹣)
B.将pH=2 的稀盐酸与pH=12的氨水等体积混合,所得溶液pH>7
C.0.10 mol?L﹣1的氨水用HNO3溶液完全中和后,溶液显中性
D.用惰性电极电解稀硫酸时,实质是电解水,溶液的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统.实验测得101kPa时,1 molH2完全燃烧生成液态水,放出285.8kJ的热量;1 mol CH4完全燃烧生成液态水和CO2 , 放出890.3kJ的热量.下列热化学方程式书写正确的是( )
A.2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJmol
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890.3 kJmol
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJmol
D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3 kJmol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com