
| A、酸式滴定管未用标准盐酸润洗 |
| B、滴定过程中不慎有液体溅出 |
| C、滴定前仰视读数,滴定后读数正确 |
| D、碱式滴定管未用待测液润洗 |
| c(酸)×V(酸) |
| V(碱) |
| c(酸)×V(酸) |
| V(碱) |
| c(酸)×V(酸) |
| V(碱) |
| c(酸)×V(酸) |
| V(碱) |
| c(酸)×V(酸) |
| V(碱) |
| c(酸)×V(酸) |
| V(碱) |
| c(酸)×V(酸) |
| V(碱) |
| c(酸)×V(酸) |
| V(碱) |
| c(酸)×V(酸) |
| V(碱) |
| c(酸)×V(酸) |
| V(碱) |


科目:高中化学 来源: 题型:
A、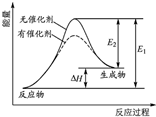 某反应的反应过程中能量变化如图所示,由如图分析可知催化剂不改变反应的焓变 | ||||||||||
| B、常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | ||||||||||
C、已知:
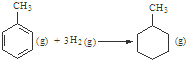 的△H为-384 kJ?mol-1 的△H为-384 kJ?mol-1 | ||||||||||
| D、常温下在0.10 mol?L-1的氨水中加入少量NH4Cl晶体,NH3?H2O的电离程度和溶液的pH均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组合分类 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 纯碱 | 盐酸 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | 烧碱 | 硫酸 | 食盐 | 氧化镁 | 一氧化碳 |
| C | 苛性钠 | 醋酸 | 碳酸铵 | 过氧化钠 | 二氧化硫 |
| D | 苛性钾 | 盐酸 | 小苏打 | 氧化钠 | 三氧化硫 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、② | C、②③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
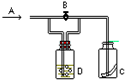 如图所示,A处通入潮湿的Cl2,关闭B阀时,C处干燥的红色布条无变化; 打开B阀时,C处干燥的红色布条褪色,则D中的溶液是( )
如图所示,A处通入潮湿的Cl2,关闭B阀时,C处干燥的红色布条无变化; 打开B阀时,C处干燥的红色布条褪色,则D中的溶液是( )| A、浓盐酸 |
| B、H2O |
| C、NaOH溶液 |
| D、饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com