
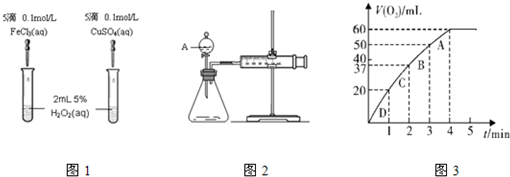
| △C |
| △t |
| n |
| V |
| △C |
| △t |
| ||
| 2mol×0.06L |
| 22.4L |
| 0.0054mol |
| 0.05L |
| △C |
| △t |


科目:高中化学 来源: 题型:
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol?L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol?L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:
 NO3-+
NO3-+ ═
═ Fe2++
Fe2++ NH4++
NH4++
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.
某同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、40% | B、50% |
| C、70% | D、80% |
查看答案和解析>>
科目:高中化学 来源: 题型:
 溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物.
溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H4 |
| B、C4H8 |
| C、C4H10 |
| D、C5H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的铝分别与足量氢氧化钠溶液和稀硝酸反应,放出的氢气一样多 |
| B、将SO2通入过量Ba(NO3)2溶液可生成BaSO4沉淀 |
| C、自来水厂常用明矾对水进行杀菌、消毒 |
| D、将稀硫酸滴加到Fe(NO3)2溶液中无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某学生用pH试纸测新制氯水的pH值,先变红后褪色,是因为Cl2有强氧化性 |
| B、向氯水中加入碳酸氢钠粉末,有气泡产生,说明氯水中含有H+ |
| C、配制一定物质的量浓度的溶液发现浓度偏低,可能由于配制溶液所用的容量瓶事先未干燥 |
| D、将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com