
����Ŀ������һ���۵�ܸߵĽ������������õĿ����Ժ͵��¿���ʴ�ԣ�����չ�ԡ�Ӳ�ȴ����ԡ��㷺Ӧ���ڸ��������պ��졢��Դ������������ҵ�ϳ��÷�¯��(��Ҫ��FeOV2O3����������SiO2��P2O5������)��ȡV2O5��������ͼ��

(1)���յ�Ŀ���ǽ�FeOV2O3ת��Ϊ������NaVO3��������Ԫ��ȫ��ת��Ϊ+3�ۣ�д���÷�Ӧ�Ļ�ѧ����ʽ _________________________________
(2)��MgSO4��Һ�IJ����У���������Ҫ�ɷ���_____________���û�ѧʽ��ʾ)��
(3)���������еķ�����Ӧ�����ӷ���ʽΪ_________________���õ��Ĺ�������������Ҫϴ�ӣ�д��ʵ����ϴ��NH4VO3�����IJ�������_______________��
(4)Ԫ�ط�����Һ�л����� ��V2��(��ɫ)��V3��(��ɫ)��VO2��(��ɫ)��VO2��(��ɫ)����ʽ���ڣ�ij���÷�Ԫ������ķ�Ӧ����ƵĿɳ���صĹ���ԭ����ͼʾ,��֪��Һ�л�����1 mol ���ᣬ��ش��������⣺

�ٳ��ʱ����۵缫�Ϸ����ĵ缫��ӦʽΪ________________
�ڷŵ�����У��Ҳ���Һ��ɫ�仯Ϊ_______________________������ʱ���·ת����3.01��1022�����ӣ��������Һ��H���ı仯����n(H��)��_________��
���𰸡�4FeOV2O5+4Na2CO3+5O2![]() 8NaVO3+2Fe2O3+4CO2 MgSiO3 Mg3��PO4)3 NH4��+VO3��=NH4VO3�� ��©���м�ˮ����û��������ˮ��Ȼ���£��ظ�2-3�� VO2��+H2O-e=VO2��+2H�� ��ɫ��Ϊ��ɫ 0.05mol
8NaVO3+2Fe2O3+4CO2 MgSiO3 Mg3��PO4)3 NH4��+VO3��=NH4VO3�� ��©���м�ˮ����û��������ˮ��Ȼ���£��ظ�2-3�� VO2��+H2O-e=VO2��+2H�� ��ɫ��Ϊ��ɫ 0.05mol
��������
��¯������̼�����ڿ����б��գ�����NaVO3���������������ơ������ƣ�ˮ����õ������к�������������ҺΪNaVO3�������ơ������Ƶ�ˮ��Һ����Һ�м�������þ�����������ܵĹ���þ������þ���������˺�����Һ���ټ������������NH4VO3������NH4VO3��������V2O5��
�������Ϸ�����(1) FeOV2O3��̼���ơ������ڸ��������·�Ӧ����NaVO3��Fe2O3��CO2���÷�Ӧ�Ļ�ѧ����ʽ��4FeOV2O5+4Na2CO3+5O2![]() 8NaVO3+2Fe2O3+4CO2��
8NaVO3+2Fe2O3+4CO2��
(2)����MgSO4��Һ���ɹ���þ������þ������������������Ҫ�ɷ���MgSiO3��Mg3��PO4)3��
(3)����������NaVO3��(NH4)2SO4������Ӧ����NH4VO3��������Ӧ�����ӷ���ʽΪNH4��+VO3��=NH4VO3����ʵ����ϴ��NH4VO3�����IJ��������ǣ���©���м�ˮ����û��������ˮ��Ȼ���£��ظ�2-3�Σ�
(4) �ٳ��ʱ����ӵ�Դ���������ص�������������۵缫Ϊ������ʧ���ӷ���������Ӧ����Ԫ�ػ��ϼ����ߣ������ĵ缫��ӦʽΪVO2��+H2O-e-=VO2��+2H����
�ڷŵ�����У��Ҳ��Ǹ���������ʧ���ӷ�Ԫ�ػ��ϼ����ߣ���V2����ΪV3������Һ��ɫ����ɫ��Ϊ��ɫ���ŵ�ʱ������ӦΪVO2��+2H��+e-=VO2��+H2O������ʱ���·ת����3.01��1022�����ӣ�ͨ���缫��Ӧ����������0.1mol��ͬʱ0.05mol���������Ҳ۽�����ۣ��������Һ��H���ı仯����n(H��)��0.1-0.05=0.05mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Т�0.112Lˮ����3.01��1023���Ȼ�����ӣ���13.6 g H2S���壻��0.2 mol���������ж����������ʵĹ�ϵ��С����������ȷ���ǣ� ��
A. ���������٢ۢڢ�B. �ܶȣ��ܢ٢ۢ�
C. �����٢ܢ�D. ��ԭ�������ڢܢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)����H=-115. 6 kJ��mol-1�� H2(g)+Cl2(g)=
2Cl2(g)+2H2O(g)����H=-115. 6 kJ��mol-1�� H2(g)+Cl2(g)=
2HCl(g)��H=-184 kJ��mol-1��
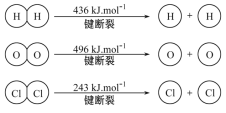
��H2��O2��Ӧ������̬ˮ���Ȼ�ѧ����ʽ��___________��
�ڶϿ�1 mol H��O����������Ϊ______ kJ��
�۸�����H2O�ɷֽ����ɷ��ӻ�ԭ�ӡ�������ˮ�ֽ���ϵ����Ҫ���������������¶ȵĹ�ϵ��ͼ��ʾ��ͼ��A��B��ʾ������������________�����ʵ���֮��Ϊ2��1��A��H2��ѧ�ܽϵ͵�������________��

��2����֪��G=��H��T����S����100 kPa��298. 15 Kʱʯ��ʯ�ֽⷴӦCaCO3(s)= CaO(s)+CO2(g)�Ħ�H=+178. 3 kJ��mol-1����S=+160. 4 J��mol-1��K-1
�ٴӼ���˹�����ܱ䣨��G���ĽǶ�˵���÷�Ӧ���������Է����е�ԭ��___________________��
����÷�Ӧ�Է����е�����¶�Ϊ__________K��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ƚ�����ȷ����
A. �۵㣺Li<Na<K
B. �ȶ��ԣ�CH4<NH3<H2O<HF
C. ���ԣ�HClO4<H2SO4<H3PO4
D. ��ԭ�ԣ�Br��<Cl��<S2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Co3O4��һ�ֵ缫���ϣ����ò�����ʪʽ���������շֽⷨ�Ʊ���
(1)����(NH4)2C2O4��Һ��CoCl2��ҺΪԭ����ȡ������ˮ��CoC2O4��2H2O���塣
����֪25 �棬Kb(NH3��H2O)��1.8��10��5��H2C2O4��Ka1��5.6��10��2��Ka2��5.4��10��5��(NH4)2C2O4��Һ��pH__ (�>����������<��)7��
�ڷ�Ӧʱ��ʹ(NH4)2C2O4������ԭ����________________________��
(2) Ϊȷ����CoC2O4��2H2O���Co3O4����������¶ȣ�ȷ��ȡ4.575 g��CoC2O4��2H2O��Ʒ���ڿ����м��ȣ�������Ʒ��ʣ���������¶ȵı仯��ͼ��ʾ(��֪385 �����ϲ��������Ϊ����������)

��B��������Ϊ________(�ѧʽ)��
�ھ��ⶨ��205��385 ������չ����У�����������ΪCO2������AB������O2�ڱ�״���µ������(д��������̣��������2λ��Ч����) ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�������Ա�������CO2��CH4ת��Ϊ�߸���ֵ��ƷCH3COOH�Ĵ���Ӧ���̡�������ʾ��ͼ���¡�(��ʾ��ԭ��������=Ŀ�������������/�μӷ�Ӧ�����з�Ӧ���������100%��������˵����ȷ����

A. �١��������������γ���C�DC��
B. CH4��CH3COOH����������C�DH����������
C. �ô�������Ч��߷�Ӧ���ƽ��ת����
D. ����CH3COOH�ܷ�Ӧ��ԭ��������С��100%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ᣨHCN����һ�־綾�����ᣬ���п�������ζ�������ˮ����ϡ�ͣ����и���ʼ�ձ����������
A. Ka(HCN) B. c(H��) C. c(CN-)/c��HCN�� D. C(HCN)/ c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(Na2FeO4)��ˮ����������ʹ�õ�һ�����;�ˮ��������ԭ��Ϊ��Fe(NO3)3+NaOH+Cl2��Na2FeO4+NaNO3+NaCl+H2O
��1����ƽ���õ����ŷ��������ת�������___
___Fe(NO3)3+___NaOH+___Cl2��___Na2FeO4+___NaNO3+___NaCl+___H2O
��2����Ӧ�е���������_____����ԭ������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڳ�����pHΪ2������,����������ȷ����
A. c(H+)=c(SO42-)+c(OH-)
B. ������pH=12�İ�ˮ��Ϻ�������Һ������
C. ��H2O�������c(H+)=1.0��10-12 mol��L-1
D. ������0.01 mol��L-1����������Һ��Ϻ�������Һ��:c(SO42-)=c(CH3COO-)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com