
【题目】铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,生产原理为:Fe(NO3)3+NaOH+Cl2→Na2FeO4+NaNO3+NaCl+H2O
(1)配平并用单线桥法标出电子转移情况:___
___Fe(NO3)3+___NaOH+___Cl2→___Na2FeO4+___NaNO3+___NaCl+___H2O
(2)反应中的氧化剂是_____;还原产物是_____。
【答案】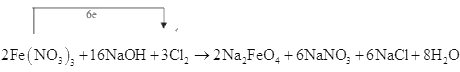 Cl2 NaCl
Cl2 NaCl
【解析】
配平氧化还原反应方程式时,首先要找出变价元素,确定首先配平的两种物质,然后按化合价升降总数相等进行配平,再利用质量守恒配其它物质的化学计量数。
(1)在反应Fe(NO3)3+NaOH+Cl2→Na2FeO4+NaNO3+NaCl+H2O中,Fe由+3价升高到+6价,Cl由0价降低到-1价。
Fe +3→+6,升高3价,按化合价升降总数相等, 2Fe升高3价×2
Cl 0→-1,降低1价, 按化合价升降总数相等, 3Cl2降低2价×3
2Fe(NO3)3+NaOH+3Cl2→2Na2FeO4+NaNO3+6NaCl+H2O
再利用质量守恒配平:
2Fe(NO3)3+16NaOH+3Cl2→2Na2FeO4+6NaNO3+6NaCl+8H2O,
答案为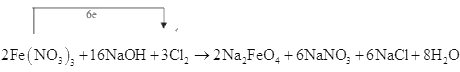 。
。
(2)在该反应中,Cl元素的化合价降低,Cl2作氧化剂;答案为Cl2。
还原产物是氧化剂对应的产物应为NaCl,答案为NaCl。


科目:高中化学 来源: 题型:
【题目】欲测定金属镁的相对原子质量,请利用如图给定的仪器组成一套实验装置(每个仪器只能使用一次,假设气体的体积可看作标准状况下的体积)。

填写下列各项(气流从左到右):
(1)各种仪器连接的先后顺序是___接___、___接___、___接___、_____接___(用小写字母表示)。
(2)连接好仪器后,要进行的操作有以下几步,其先后顺序是____(填序号)。
①待仪器B中的温度恢复至室温时,测得量筒C中水的体积为V0 mL;
②擦掉镁条表面的氧化膜,将其置于天平上称量,得质量为w g,并将其投入试管B中的带孔隔板上;
③检查装置的气密性;
④旋开装置A上分液漏斗的活塞,使其水顺利流下,当镁完全溶解时再关闭这个活塞,这时A中共放入水V1mL。
(3)根据实验数据可算出金属镁的相对原子质量,其数学表达式为____。
(4)若试管B的温度未冷却至室温,就读出量筒C中水的体积,这将会使所测定镁的相对原子质量数据____(填“偏大”“偏小”或“无影响”)。
(5)仔细分析上述实验装置后,经讨论认为结果会有误差,于是又设计了如图所示的实验装置。
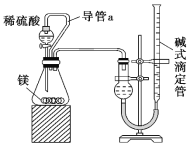
装置中导管a的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。工业上常用钒炉渣(主要含FeOV2O3,还有少量SiO2、P2O5等杂质)提取V2O5的流程如图:

(1)焙烧的目的是将FeOV2O3转化为可溶性NaVO3,其中铁元素全部转化为+3价,写出该反应的化学方程式 _________________________________
(2)加MgSO4溶液的步骤中,滤渣的主要成分是_____________(用化学式表示)。
(3)沉钒过程中的发生反应的离子方程式为_________________,得到的固体物质往往需要洗涤,写出实验室洗涤NH4VO3沉淀的操作方法_______________。
(4)元素钒在溶液中还可以 以V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO2+(黄色)等形式存在.某利用钒元素微粒间的反应来设计的可充电电池的工作原理如图示,已知溶液中还含有1 mol 硫酸,请回答下列问题:

①充电时,左槽电极上发生的电极反应式为________________
②放电过程中,右槽溶液颜色变化为_______________________,若此时外电路转移了3.01×1022个电子,则左槽溶液中H+的变化量Δn(H+)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g) ![]() N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) ![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) ![]() 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是________,操作②的名称是____________。
(2)试剂a是____________(填化学式,下同),试剂b是__________,固体B是____________。
(3)加入试剂a所发生反应的化学方程式为__________________________________。
加入试剂b所发生反应的化学方程式为____________________________________。
(4)该方案能否达到实验目的:__________________________(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)__________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
(1)氧化剂_____,还原剂_____;
(2)反应中转移电子数是_____;
(3)氧化剂与氧化产物的质量比_____;
(4)当生成2.8gN2时,被氧化的物质的质量是____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下CO与CH4燃烧的热化学方程式分别为:2CO(g)+O2(g)→2CO2(g)+566kJ,CH4(g)+2O2(g)→2CO2(g)+2H2O(l)+890kJ,有76g甲烷与一氧化碳的混合气体在上述条件下充分燃烧,释放的能量为2953kJ,则混合气体的平均相对分子质量为多少?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述正确的是

A. 若R为甲基则该物质的分子式可以表示为C16H10O7
B. 分子中有三个苯环
C. lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4mol、8mol
D. 1mol该物质与足量溴水反应耗6molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,可通过实验的方法加以确定,下列说法中错误的是( )
A. 加入含有NaOH的酚酞溶液,红色褪去,说明有H+存在
B. 加入有色布条后,有色布条退色,说明有HClO分子存在
C. 氯水呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在
D. 加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com