
【题目】天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述正确的是

A. 若R为甲基则该物质的分子式可以表示为C16H10O7
B. 分子中有三个苯环
C. lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4mol、8mol
D. 1mol该物质与足量溴水反应耗6molBr2
【答案】CD
【解析】
A、根据结构简式和键线式的特点来书写分子式;
B、根据有机物的结构可以得出分子中苯环数目;
C、维生素P结构中含有酚羟基,能与氢氧化钠反应,含有的苯环、碳碳双键、碳氧双键都能与氢气发生加成反应;
D、维生素P结构中含有酚羟基、碳碳双键,可以分别和溴发生取代和加成反应。
A、根据维生素P的结构简式可以得出其分子式为 C16H10O7,故A错误;
B、维生素P结构中含有两个苯环,故B错误;
C、维生素P结构中含有的苯环、碳碳双键、碳氧双键都能与氢气发生加成反应,一定条件下1mol该物质可与氢气加成,耗氢气最大量为8mol;维生素P结构中含有酚羟基,能与氢氧化钠反应,每1mol维生素P结构中含有4mol酚羟基,所以1mol该物质可与4molNaOH反应,故C正确;
D、结构中含有酚羟基,能与溴水反应,发生-OH的邻、对位取代反应,含有碳碳双键,能发生加成反应, 所以1mol该物质与足量溴水反应耗6molBr2,故D正确;
综上所述,本题选CD。


科目:高中化学 来源: 题型:
【题目】下列各组比较中正确的是
A. 熔点:Li<Na<K
B. 稳定性:CH4<NH3<H2O<HF
C. 酸性:HClO4<H2SO4<H3PO4
D. 还原性:Br-<Cl-<S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,生产原理为:Fe(NO3)3+NaOH+Cl2→Na2FeO4+NaNO3+NaCl+H2O
(1)配平并用单线桥法标出电子转移情况:___
___Fe(NO3)3+___NaOH+___Cl2→___Na2FeO4+___NaNO3+___NaCl+___H2O
(2)反应中的氧化剂是_____;还原产物是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醇、甲醚等有机物,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
(1)已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
开始时 | a | b | 0 | 0 |
10 s时 | 3 | 0.5 | c | 1.5 |
①若T K时,化学平衡常数K=15,则10 s 时v(正)_______v(逆)(填“>”“<”或“=”),此时CO2的转化率为________。
②既能提高反应速率,又能提高H2转化率的方法是___________(填序号)。
A.加入过量CO2气体 B.升高温度 C.适当压缩容器体积 D. 将CH3OCH3(g) 分离出去
(2)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
①下图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为______(填“a”或“b”),其判断依据是__________________________________。

②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如图2所示,则在该时间段内,恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类研究的重要课题,目前工业合成氨的原理为:N2(g) + 3H2(g) ![]() 2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下:
时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)=____________。
②平衡时,H2的转化率为______;
该温度下,反应2NH3(g)![]() N2(g) + 3H2(g) 的平衡常数K=_______ (mol/L)2。
N2(g) + 3H2(g) 的平衡常数K=_______ (mol/L)2。
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3的浓度与上表中相同的为_______(填选项字母)。
A.a=l、b=3、c=0 B.a=4、b=12、c=0
C.a=0、b=0、c=4 D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286.0kJ/mol,则用N2与水反应制NH3的热化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生活生产中应用广泛,下列说法错误的是( )
A. 除夕夜色彩斑斓的烟火利用了金属的焰色反应
B. 减少汽车尾气的排放是控制酸雨危害的途径之一
C. 纯碱是钠的重要化合物之一,可用于治疗胃酸过多
D. 乙烯可以用来衡量一个国家的石油化工发展水平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下pH为2的硫酸,下列叙述正确的是
A. c(H+)=c(SO42-)+c(OH-)
B. 与等体积pH=12的氨水混合后所得溶液显酸性
C. 由H2O电离出的c(H+)=1.0×10-12 mol·L-1
D. 与等体积0.01 mol·L-1的乙酸钠溶液混合后所得溶液中:c(SO42-)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废催化剂含有SiO2、ZnO、CuS、ZnS、Fe3O4等物质,为落实“节约资源,变废为宝”的环保理念,某课外兴趣小组的同学取20g该物质进行实验,回收其中的Cu和Zn,实验方案如下:
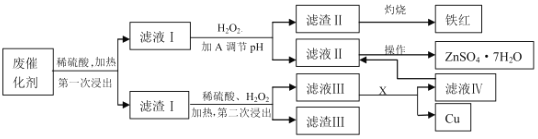
已知:ZnS可与稀硫酸反应;CuS不溶于稀硫酸,也不与其发生反应。请回答下列问题:
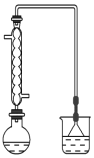
(1)可用图装置进行第一次浸出,烧杯中盛放的是______溶液。
(2)滤液Ⅰ中的Fe2+最好用______来检验。
a.氯水 b.双氧水 c.KSCN溶液 d.K3[Fe(CN)6]溶液
(3)物质A是含有X元素的氧化物(XO),则X是______(填元素符号),由滤液Ⅱ、Ⅳ滤液获得ZnSO47H2O的操作是______________。
(4)第二次浸出时的化学方程式为_______________。
(5)加A调节溶液的pH约为______时,可以完全除去其中的杂质离子。
(当溶液中离子浓度小于等于10-5mol/L时视为沉淀完全;实验条件下部分物质的溶度积常数为:Ksp[Fe(OH)3]=10-38,Ksp[Fe(OH)2]=10-17,Ksp[Zn(OH)2]=10-17,Ksp[Cu(OH)2]=10-20)
(6)实验最后获得了5.74gZnSO47H2O晶体(假设实验中没有损耗),但不能由此确定原催化剂中锌元素的质量分数,原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型NaBH4/H2O2燃料电池(DBFC)的结构如图,该电池总反应方程式为NaBH4+4H2O2===NaBO2+6H2O,下列有关说法错误的是

A. 放电过程中,Na+向B极区迁移
B. 电池A极区的电极反应式为BH4-+8OH――8e-===BO2-+6H2O
C. 外电路中,电子的流向为B经过导线到A
D. 在电池反应中,每消耗1L 6mol·L-1H2O2溶液,理论上流过电路中的电子数为12NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com