
【题目】根据下列实验和现象,所得实验结论正确的是( )
选项 | 实验 | 现象 | 实验结论 |
A | 向某溶液中先滴加适量稀硝酸,再滴加少量BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
B | 向装有Fe(NO3)2溶液的试管中加入稀硫酸 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
C |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
D | SO2和SO3混合气体通入Ba(NO3)2溶液 | 出现白色沉淀 | 得到的沉淀只有BaSO4 |
A. A B. B C. C D. D
【答案】D
【解析】A、含有Ag+的溶液与BaCl2反应也能生成白色沉淀;B、硝酸盐溶液中加入稀硫酸,构成的硝酸与还原性微粒反应,NO3-被还原为NO,NO遇空气生成红棕色的NO2;C、在同一硬质玻璃管中,Cl2和Br2都能把I-氧化生成I2;D、SO3溶于水生成硫酸,电离出的H+与NO3-构成的硝酸能把SO2氧化为SO42-。
A、加入的硝酸能把SO32-、HSO3-氧化为SO42-,再加入BaCl2都能生成白色沉淀BaSO4,所以溶液含有SO42-、SO32-、HSO3-中的一种或几种,但是若溶液中含有Ag+,也能与BaCl2反应生成白色沉淀,因此A不正确;
B、加入的硫酸与NO3-构成硝酸,能氧化Fe2+,而NO3-被还原为NO,NO遇空气生成红棕色的NO2,故硝酸分解生成NO2的结论是不正确;
C、含有NaBr的棉球显橙色,说明Cl2的氧化性强于Br2,因溴易挥发,与Cl2一起与含有KI淀粉的棉球作用而呈蓝色,无法确定是哪种物质把I-氧化为I2,故结论不正确;
D、SO3溶于水生成硫酸,电离出的H+与NO3-构成的硝酸把SO2氧化为SO42-,所以白色沉淀只有BaSO4,故D的结论是正确的。本题答案为D。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.![]() 和
和![]() 是2种核素,他们互称同位素B.C60与C70互称同素异形体
是2种核素,他们互称同位素B.C60与C70互称同素异形体
C.CH3CH2OH和CH3OCH3互为同系物D.硝基苯可看成是由苯基和-NO2两种基团组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
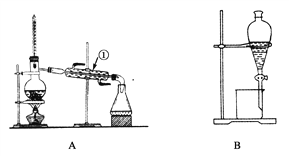
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中 的Cl-等杂质,选择装置________________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________________。
(3)装置A中①的名称是________,进水的方向是从________(填“上”或“下”)口进水。装置B在分液时为使液体顺利下滴,应进行的具体操作是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
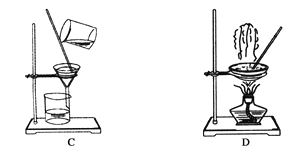
【题目】用下列装置进行相应实验,能达到实验目的的是

图1 图2 图3 图4
A. 图1所示装置制取并收集氨气
B. 图2所示装置用于制备并收集NO气体
C. 图3所示装置用于除去碳酸氢钠固体中的少量碳酸钠
D. 图4所示装置用于Na2CO3和稀H2SO4反应制取少量的CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由常见元素组成的一些单质及其化合物之间的转化关系图。常温常压下,B、E、F、H、I均为气体,F无色无味,且能使澄清石灰水变浑蚀;B、E、I均有刺激性气味,E能使湿润的红色石蕊试纸变蓝,B、E在空气中相遇会产生白烟,I为红棕色。A是一种常见的氮肥,F也能由A直接分解可得到。C、G、K的焰色反应呈黄色。(反应中部分生成物己略去)

请回答下列问题:
(1) 物质D的化学式为______,D的其水溶液中阳离子的检验方法为(文字表述):______。
(2)写出反应③的化学方程式:______
(3)写出反应④的离子方程式:______
(4)写出物质E的电子式:______
查看答案和解析>>
科目:高中化学 来源: 题型:
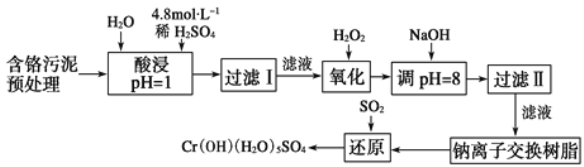
【题目】利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
某工厂对制革工业污泥中Cr元素的回收与再利用工艺如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1) 酸浸时,为了提高浸取率可采取的措施是____(至少写两条)。
(2)H2O2的作用是_____。
(3)调pH=8是为了除去___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)已知以下氧化还原反应方程式(未配平):Na2Cr2O7+SO2+H2O=Cr(OH)(H2O)5SO4+Na2SO4;以上反应各物质的配平系数依次为___。每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如下图所示。下列说法正确的是( )
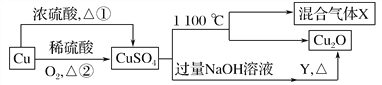
A. 相对于途径②,途径①更好地体现了绿色化学思想
B. Y可以是葡萄糖溶液
C. X可能是SO2和SO3的混合气体
D. 将CuSO4溶液蒸发,利用余热蒸干,可制得胆矾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
(1)已知CO(g)、H2(g)的标准燃烧热分别为 △H=-283kJmol-1, △H=-286kJmol-1,且CH3OH(g)+3/2O2(g) ![]() CO2(g)+2H2O(l) △H=-761kJmol-1;则CO(g)+ 2H2(g)
CO2(g)+2H2O(l) △H=-761kJmol-1;则CO(g)+ 2H2(g)![]() CH3OH(g)的△H= ___________。
CH3OH(g)的△H= ___________。
(2)为了提高CO和H2制备甲醇生产效率和产量;工业生产中通常采取的措施是___________________________________________。(写出两点)
(3)实验室模拟用CO和H2反应来制甲醇,在250 ℃下,将一定量的CO和H2投入10 L的密闭容器中,各物质的物质的量浓度(mol·L-1)变化如下表所示:
2 min | 4 min | 6 min | |
CO | 0.07 | 0.05 | 0.05 |
H2 | x | 0.10 | 0.10 |
CH3OH | 0.03 | 0.05 | 0.05 |
①250 ℃时,该反应的平衡常数K=___________;
②在图1中画出反应开始至第6 min时H2的物质的量的变化曲线,并标出合适的纵坐标。_______
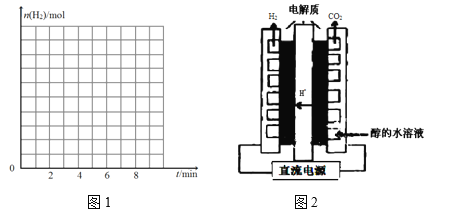
(4)利用电解甲醇水溶液制备氢气最大的优点就是需要的电压低,装置如图2,写出 阳极电极反应方程式____________________________________________________,电解的总反应化学方程式__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com