
【题目】金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性,它兼具铁的高强度和铝的低密度。其单质和化合物具有广泛的应用价值。氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2 (如图1)。

图中的M是短周期金属元素,M的部分电离能如下表:
I1 | I2 | I3 | I4 | I5 | |
电离能/kJ·mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
请回答下列问题:
(1)Ti的基态原子外围电子排布式为_______________。
(2)M是_______(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为_______。
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中一个苯环的σ键有____个,化合物乙中碳,氧,氮三个原子对应的第一电离能由大到小的顺序为____________。


(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a×10-10 cm,则该氮化钛的密度为______ g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。
(5)图3中Ti3+可形成配位数为6的空间构型,问它构成的立体构型为______面体。
【答案】3d24s2 Mg 12 12 N > O >C ![]() 八
八
【解析】
(1)Ti 是22号元素,其原子核外有22个电子,3d、4s电子为其外围电子,根据构造元素书写其外围电子排布式;
(2)M是短周期金属元素,根据其电离能知,该金属位于第IIA族,能还原四氯化钛,说明其金属性较强,为Mg;该金属晶体的堆积模型为六方最密堆积,配位数=3![]() 8
8![]() ;
;
(3) 化合物甲的分子中一个苯环含有7个碳碳键的σ键和5个碳氢单键的σ键;
同一周期元素,随着核电荷数递增,原子半径减小,失电子能力降低,第一电离能增大,但由于N元素原子轨道的半满的结构的能量比较低,导致第一电离能比相邻元素的大;
(4)根据均摊法,可以知道该晶胞中N原子个数为:6![]() +8
+8![]() =4,该晶胞中Ti原子个数为:1+12
=4,该晶胞中Ti原子个数为:1+12![]() ,所以晶胞的质量m=4
,所以晶胞的质量m=4![]() g,而晶胞的体积V=(2a
g,而晶胞的体积V=(2a![]() 10-10)3cm3,所以晶体的密度=
10-10)3cm3,所以晶体的密度=![]() ; (5)由图3可知,Ti3+可形成配位数为6的空间构型,6个N3-构成的立体构型为八面体。
; (5)由图3可知,Ti3+可形成配位数为6的空间构型,6个N3-构成的立体构型为八面体。
(1)Ti为22号元素,原子核外电子排布为1s22s22p63s23p63d24s2,其3d、4s能级上的电子为其价电子,这两个能级上分别含有2个电子,则该原子价电子排布式为3d24s2,
因此,本题正确答案是:3d24s2;
(2)M是短周期金属元素,M的第三电离能剧增,处于ⅡA族,能与TiCl4反应置换出Ti,则M为Mg;Mg晶体属于六方最密堆积,配位数=3![]() 8
8![]() =12;
=12;
因此,本题正确答案是:Mg;12;
(3) 化合物甲的分子中一个苯环含有7个碳碳键的σ键和5个碳氢单键的σ键,共12个σ键;
同一周期元素,随着核电荷数递增,第一电离能增大,但由于N元素原子轨道的半满的结构的能量比较低,导致第一电离能比相邻元素的大,碳,氧,氮三个原子对应的第一电离能由大到小的顺序为N > O >C;
因此,本题正确答案是:12; N > O >C;
(4) 根据均摊法,可以知道该晶胞中N原子个数为:6![]() +8
+8![]() =4,该晶胞中Ti原子个数为:1+12
=4,该晶胞中Ti原子个数为:1+12![]() =4,所以晶胞的质量m=4
=4,所以晶胞的质量m=4![]() g,而晶胞的体积V=(2a
g,而晶胞的体积V=(2a![]() 10-10)3cm3,所以晶体的密度
10-10)3cm3,所以晶体的密度![]() =
=![]() =4
=4![]() g
g ![]() (2a
(2a![]() 10-10)3cm3=
10-10)3cm3=![]() g·cm-3,
g·cm-3,
因此,本题正确答案是:![]() ;
;
(5) 由图3可知,Ti3+可形成配位数为6的空间构型,6个N3-构成的立体构型为八面体,
因此,本题正确答案是:八。


科目:高中化学 来源: 题型:
【题目】短周期主族元素 Q、W、X、Y、Z原子序数依次增加,其中Q、W原子核外L 电子层的电子数分别为0、4,X、Y、Z在周期表中的位置如图所示。 下列说法不正确的是
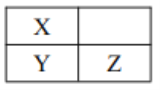
A. W、 X、 Q 的原子半径依次减小 B. Y 的最高价氧化物的水化物一定是强酸
C. W 和 Z 可能形成化合物W3Z8 D. Q、 X、 Z 可能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 以淀粉为原料可制取乙酸乙酯
B. 聚氯乙烯分子中含碳碳双键
C. 丁烷有3种同分异构体
D. 油脂的皂化反应属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2=P4O10已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )

A. (4c+12b-6a-5d) kJ·mol-1 B. (6a+5d-4c-12b) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1 D. (4c+5d-4a-12b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气态烃A在标准状况下的密度为1.25 g·L-1,C能够发生银镜反应, E与B、D均能发生酯化反应。有关物质的转化关系如下:

请回答:
(1) F的结构简式______。
(2) A→B的反应类型______。
(3) C→D的化学方程式______。
(4) 下列说法不正确的是______。
A.将金属钠投入B中,金属钠沉入底部,并缓慢的放出气泡
B.2 mol F可以反应产生1 mol环状化合物,其分子式为C4H6O5
C.G加入NaHCO3溶液中会产生气体
D.1 mol H可以与含2 mol NaOH的水溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】球形纳米银粉是一种重要的无机功能材料,被广泛应用于装饰材料、电接触材料、感光材料、催化剂、医药和抗菌材料等众多领域。从含Ag+的废定影液中回收并制备球形纳米银粉工艺流程图如下:

请回答下列问题:
(1)硝酸中所含元素的原子半径由小到大的顺序:____________;Na在周期表中的位置: _____________;N2H4的电子式:______________。
(2)为使Na2S溶液中![]() 的值减小,可加入的物质是__________。
的值减小,可加入的物质是__________。
A.盐酸 B.适量KOH C.适量NaOH D.适量CH3COONa
(3)写出置换过程的离子反应方程式 _____________________________________。
(4)若氧化精制过程产生等体积的NO2和NO混合气体,写出HNO3与Ag反应的化学反应方程式_____________。
(5)下图分别是HNO3浓度、浸取时间对银回收的影响,则最佳的浓度和时间分别是_____%;___min。


(6)加入N2H4·H2O还原前要将AgNO3溶液的pH调节至5~6,得到Ag的产率最高,pH>6时,银的产率降低的原因为__________________________。
(7)常温下,取上述AgNO3溶液滴加到物质的量浓度均为0.2mol/L NaNO2和CaCl2的混合溶液中(忽略溶液体积变化),当AgNO2开始沉淀时,溶液中c(Cl-)=__________mol/L[已知:常温下,Ksp(AgNO2)=2×10-8 ,Ksp(AgCl)=1.8×10-10]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究和验证氯气的性质,某研究性学习小组以MnO2和浓盐酸为主要原料,设计了如图所示装置(其中a是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞)进行了研究。

(资料:氯气与铁反应制取氯化铁要在无水条件下进行)
试回答下列问题:
(l)装置A中发生反应的化学方程式为_____________________
(2)装置B中的试剂为_________,装置D里的药品是________
(3)装置C中发生反应的离子方程式为_____________________________
(4)反应开始后,装置E中玻璃管内的现象为_______________________________;可以检验生成物中有Fe3+的试剂是__________.
(5)装置F中发生反应的化学方程式为________________________
(6)利用氯气可以制得漂白粉,漂白粉的有效成份是_______________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块钠用小刀切开,可以看到表面光亮,但很快变暗,该反应的化学方程式为__________,若将钠块放到石棉网上加热会生成______色固体,该反应的化学方程式为_______,该固体遇水会有无色无味的气体生成,该反应的化学方程式为___________,将氯气通入反应后的溶液中,发生反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为________。

(2)如图,装置进行NH3性质实验,A、B为体积相等的两个烧瓶。

①先打开旋塞1,B瓶中的现象是___________________________,稳定后,关闭旋塞1;
②再打开旋塞2,B瓶中的现象是___________________________。
(3)为了探究某一种因素对溶液中NH4Cl水解程度的影响,限制使用的试剂与仪器为固体NH4Cl,蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、PH计、温度计、恒温水浴槽(可控制温度),某同学拟定了如下实验表格:

①该同学的实验目的是探究_____________对溶液中NH4Cl水解程度的影响。
②按实验序号1所拟数据计算NH4Cl水解反应的平衡转化率为___________(只列出算式,忽略水自身电离的影响)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com