
【题目】将一小块钠用小刀切开,可以看到表面光亮,但很快变暗,该反应的化学方程式为__________,若将钠块放到石棉网上加热会生成______色固体,该反应的化学方程式为_______,该固体遇水会有无色无味的气体生成,该反应的化学方程式为___________,将氯气通入反应后的溶液中,发生反应的化学方程式为_________。
【答案】4Na + O2 = 2Na2O 淡黄色 2Na + O2 ![]() Na2O2 2Na2O2 +2H2O = 4NaOH +O2↑ Cl2 + 2NaOH = NaCl + NaClO + H2O
Na2O2 2Na2O2 +2H2O = 4NaOH +O2↑ Cl2 + 2NaOH = NaCl + NaClO + H2O
【解析】
钠的性质活泼,在空气中很容易被氧化为氧化钠;在空气中加热反应得到过氧化钠;过氧化钠与水反应生成氢氧化钠和氧气;氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠,据此分析解答。
钠的性质活泼,将一小块钠用小刀切开,可以看到表面光亮,但很快变暗,是钠被空气中的氧气氧化为氧化钠,反应的化学方程式为:4Na+O2═2Na2O;在空气中加热,钠与氧气反应得到淡黄色的过氧化钠,反应的化学方程式为:2Na+O2 ![]() Na2O2;过氧化钠与水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O═4NaOH+O2↑;氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠,反应的化学方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,故答案为:4Na+O2═2Na2O;淡黄色;2Na+O2
Na2O2;过氧化钠与水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O═4NaOH+O2↑;氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠,反应的化学方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,故答案为:4Na+O2═2Na2O;淡黄色;2Na+O2 ![]() Na2O2 ;2Na2O2+2H2O═4NaOH+O2↑;Cl2+2NaOH═NaCl+NaClO+H2O。
Na2O2 ;2Na2O2+2H2O═4NaOH+O2↑;Cl2+2NaOH═NaCl+NaClO+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(加试题)烟气(主要污染物SO2、NO、NO2)的大量排放造成严重的大气污染,国内较新研究成果是采用以尿素为还原剂的脱硫脱硝一体化技术。
(1)脱硫总反应:SO2(g)+CO(NH2)2(aq)+2H2O(l)+1/2O2(g)=(NH2)SO4(aq)+CO2(g),已知该反应能自发进行,则条件是____(填“高温”、“低温”或“任何温度”)。
(2)电解稀硫酸制备O3(原理如图),则产生O3的电极反应式为______。


(3)室温下,往恒容的反应器中加入固定物质的量的SO2和NO,通入O3充分混合。反应相同时间后,各组分的物质的量随n(O3)∶n(NO)的变化见上图。
① n(NO2)随n(O3)∶n(NO)的变化先增加后减少,原因是____。
② 臭氧量对反应SO2(g)+O3(g)=SO3(g)+O2(g)的影响不大,试用过渡态理论解释可能原因__。
(4)通过控制变量法研究脱除效率的影响因素得到数据如下图所示,下列说法正确的是____。
A. 烟气在尿素溶液中的反应:v(脱硫)<v(脱硝)
B. 尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响
C. 强酸性条件下不利于尿素对氮氧化物的脱除
D. pH=7的尿素溶液脱硫效果最佳


(5)尿素的制备:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
① 该反应10 min 后达到平衡,测得容器中气体密度为4.8 g·L-1,平衡常数K=__。

② 上图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到3min 时,迅速将体系升温,请在图中画出3~10 min 内容器中尿素的物质的量的变化趋势曲线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性,它兼具铁的高强度和铝的低密度。其单质和化合物具有广泛的应用价值。氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2 (如图1)。

图中的M是短周期金属元素,M的部分电离能如下表:
I1 | I2 | I3 | I4 | I5 | |
电离能/kJ·mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
请回答下列问题:
(1)Ti的基态原子外围电子排布式为_______________。
(2)M是_______(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为_______。
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中一个苯环的σ键有____个,化合物乙中碳,氧,氮三个原子对应的第一电离能由大到小的顺序为____________。


(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a×10-10 cm,则该氮化钛的密度为______ g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。
(5)图3中Ti3+可形成配位数为6的空间构型,问它构成的立体构型为______面体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用C、Mg和Al组成的混合物进行如下图所示实验。填写下列空白。
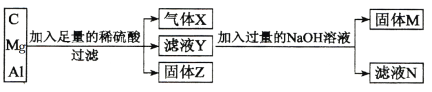
(1)气体X为 _________,固体Z为_____________。
(2)滤液Y中除H+外,还含有的阳离子为_________与__________;其中镁和稀硫酸反应的化学方程式为_________________________________________。
(3)滤液N中除Na2SO4和NaOH外,还含有的溶质为____________(填化学式);生成该物质的离子方程式为:________________________________。
(4)生成固体M的离子方程式为:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同的条件下进行合成氨反应,N2 (g)+3H2 (g)![]() 2NH3(g),根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
2NH3(g),根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
A. v(NH3)=0.1mol/(L·min) B. v(NH3)=0.2mol/(L·min)
C. v(N2)=0.3mol/(L·min) D. v(H2)=0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)→2H2O (g)+ 483.6 kJ,2H2(g)+O2(g)→2H2O (l)+ 571.6 kJ;图中示意正确的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的CH4、H2、O2、N2四种气体,体积最大的是____,(填化学式,下同),分子数最多的是____,密度最大的是____,原子数最多的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体 | Na2O2没有变质 |
B | 取少许CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液,最终无淡黄色沉淀 | CH3CH2Br没有水解 |
C | 室温下,用pH试纸测得:0.1 mol·L-1 Na2SO3溶液的pH约为10,0.1 mol·L-1 NaHSO3溶液的pH约为5 | HSO |
D | 向少量碘水中加入过量浓FeCl2溶液,分成两等份,向一份中滴加KSCN溶液显红色;向另一份中滴加淀粉溶液显蓝色 | Fe3+与I-的反应为可逆反应 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硫及其化合物在工农业生产生活中有着重要作用。回答下列问题:
(1)有人设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0 kJ·mol1、283.0 kJ·mol1,请写出CO还原SO2的生成CO2和S(s)热化学方程式________________。
(2)某科研小组研究臭氧氧化碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
已知该体系中臭氧发生分解反应:2O3(g)![]() 3O2(g)。请回答:其它条件不变,每次向容积为2 L的反应器中充入含2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
3O2(g)。请回答:其它条件不变,每次向容积为2 L的反应器中充入含2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
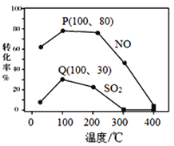
①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_____________________________________________________________________________。
②下列说法正确的是________。
A.Q点一定为平衡状态点
B.其它条件不变,若扩大反应器的容积可提高NO和SO2的转化率
C.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
③假设100℃时P、Q均为平衡点,此时反应时间为5min,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是___________;SO2的平均反应速率为________;反应Ⅰ在此时的平衡常数为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com