
【题目】氮、硫及其化合物在工农业生产生活中有着重要作用。回答下列问题:
(1)有人设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0 kJ·mol1、283.0 kJ·mol1,请写出CO还原SO2的生成CO2和S(s)热化学方程式________________。
(2)某科研小组研究臭氧氧化碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
已知该体系中臭氧发生分解反应:2O3(g)![]() 3O2(g)。请回答:其它条件不变,每次向容积为2 L的反应器中充入含2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
3O2(g)。请回答:其它条件不变,每次向容积为2 L的反应器中充入含2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
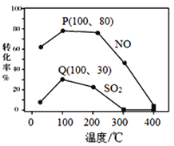
①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_____________________________________________________________________________。
②下列说法正确的是________。
A.Q点一定为平衡状态点
B.其它条件不变,若扩大反应器的容积可提高NO和SO2的转化率
C.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
③假设100℃时P、Q均为平衡点,此时反应时间为5min,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是___________;SO2的平均反应速率为________;反应Ⅰ在此时的平衡常数为_______________。
【答案】2CO(g)+SO2(g)=2CO2(g)+S(s) ΔH=-270 kJ·mol1 反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应 CD 1.4 mol 0.06mol/(L·min) 8
【解析】
(1)燃烧热是指101kPa,1mol可燃物完全燃烧生成稳定氧化物放出的热量,写热化学方程式,根据盖斯定律计算得到CO还原SO2的生成CO2和S(s)热化学方程式;
(2)①反应活化能越小反应越容易进行;
②A.图象为反应相同时间t后的转化率,反应经历时间t后,并不一定达到化学平衡;
B.其它条件不变,若扩大反应器的容积,相当于对反应减压,考虑到O3的分解反应,利于臭氧分解为O2,O3浓度减小,不利于反应正向进行;
C.根据图象,温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零;
D.脱除SO2过程反应不易进行,转化率较低,后续步骤碱吸收可以有效脱硫;
③其它条件不变,每次向容积为2L的反应器中充入含2.0mol NO、2.0mol SO2的模拟烟气和4.0mol O3,反应Ⅰ中NO转化率为80%,反应的NO为1.6mol,反应的O3为1.6mol;反应Ⅱ中SO2的转化率30%,反应的二氧化硫0.6mol,反应的O3为0.6mol;2O3(g)![]() 3O2(g),发生分解反应的臭氧占充入臭氧总量的10%,为0.4mol,则体系中剩余O3的物质的量=4.0mol-1.6mol-0.6mol-0.4mol=1.4mol;
3O2(g),发生分解反应的臭氧占充入臭氧总量的10%,为0.4mol,则体系中剩余O3的物质的量=4.0mol-1.6mol-0.6mol-0.4mol=1.4mol;
SO2的平均反应速率由公式:反应速率=△c/△t计算。
平衡状态下O2物质的量=1.6mol+0.6mol+0.6mol=2.8mol,O3物质的量1.4mol,NO剩余物质的量=2mol-1.6mol=0.4mol,过程中生成NO2物质的量1.6mol,据此计算平衡常数。
(1)已知S和CO的燃烧热分别是296.0 kJ·mol1 、283.0 kJ·mol1,热化学方程式为:
①S(s)+O2(g)═SO2(g)△H1=-296.0kJ·mol-1
②CO(g)+1/2O2(g)=CO2(g)△H2=-283.0kJ·mol-1
盖斯定律计算②×2-①得到:2CO(g)+SO2(g)=2CO2(g)+S(s)△H=-270 kJ·mol-1;
(2)①反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应,相同温度下NO的转化率远高于SO2的原因是:反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应;
②A.图象为反应相同时间t后的转化率,反应经历时间t后,并不一定达到化学平衡,所以Q点不一定为平衡点,故A错误;
B.其它条件不变,若扩大反应器的容积,相当于对反应减压,考虑到O3的分解反应,利于臭氧分解为O2,O3浓度减小,不利于反应正向进行,所以不能提高NO和SO2的转化率,故B错误;
C.根据图象,温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零,故C正确;
D.脱除SO2过程反应不易进行,转化率较低,后续步骤碱吸收可以有效脱硫,故D正确,
故答案为:CD;
③其它条件不变,每次向容积为2L的反应器中充入含2.0mol NO、2.0mol SO2的模拟烟气和4.0mol O3,反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g)△H1=-200.9kJ·mol-1 Ea1=3.2kJ·mol-1,反应中NO转化率为80%,反应的NO为1.6mol,反应的O3为1.6mol;反应Ⅱ:SO2(g)+O3(g)
NO2(g)+O2(g)△H1=-200.9kJ·mol-1 Ea1=3.2kJ·mol-1,反应中NO转化率为80%,反应的NO为1.6mol,反应的O3为1.6mol;反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1,反应中SO2的转化率30%,反应的二氧化硫0.6mol,反应的O3为0.6mol;2O3(g)
SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1,反应中SO2的转化率30%,反应的二氧化硫0.6mol,反应的O3为0.6mol;2O3(g)![]() 3O2(g),发生分解反应的臭氧占充入臭氧总量的10%,为0.4mol,则体系中剩余O3的物质的量=4.0mol-1.6mol-0.6mol-0.4mol=1.4ol,
3O2(g),发生分解反应的臭氧占充入臭氧总量的10%,为0.4mol,则体系中剩余O3的物质的量=4.0mol-1.6mol-0.6mol-0.4mol=1.4ol,
SO2的平均反应速率=△c/△t=0.6mol/(2L×5min)=0.06mol/(L·min),
平衡状态下O2物质的量=1.6mol+0.6mol+0.6mol=2.8mol,O3物质的量1.4mol,NO剩余物质的量=2mol-1.6mol=0.4mol,过程中生成NO2物质的量1.6mol,据此计算平衡常数,NO(g)+O3(g )![]() NO2(g)+O2(g),平衡常数K=
NO2(g)+O2(g),平衡常数K=![]() =8。
=8。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】将一小块钠用小刀切开,可以看到表面光亮,但很快变暗,该反应的化学方程式为__________,若将钠块放到石棉网上加热会生成______色固体,该反应的化学方程式为_______,该固体遇水会有无色无味的气体生成,该反应的化学方程式为___________,将氯气通入反应后的溶液中,发生反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为________。

(2)如图,装置进行NH3性质实验,A、B为体积相等的两个烧瓶。

①先打开旋塞1,B瓶中的现象是___________________________,稳定后,关闭旋塞1;
②再打开旋塞2,B瓶中的现象是___________________________。
(3)为了探究某一种因素对溶液中NH4Cl水解程度的影响,限制使用的试剂与仪器为固体NH4Cl,蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、PH计、温度计、恒温水浴槽(可控制温度),某同学拟定了如下实验表格:

①该同学的实验目的是探究_____________对溶液中NH4Cl水解程度的影响。
②按实验序号1所拟数据计算NH4Cl水解反应的平衡转化率为___________(只列出算式,忽略水自身电离的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较中,正确的是( )
A. 同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B. 0.2 mol·L-1NH4Cl和0.1 mol·L-1NaOH溶液等体积混合后:c(![]() )>c(Cl-)>c(Na+)>c(OH-)>c(H+)
)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
C. 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
D. 同浓度的下列溶液中,①(NH4)2SO4、②NH4Cl、③CH3COONH4、④NH3·H2O;c(![]() )由大到小的顺序是:①>②>③>④
)由大到小的顺序是:①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的 物质的量浓度的负对数与溶液的pH的变化悄况如图所示。

下列说法正确的是( )
A. 曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B. ![]()
C. 溶液中水的电离程度:M>N
D. N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某品牌食用碘盐包装上的部分文字,下列叙述不正确的是

A. 包装上的(以I计)中的“I”指的是碘元素
B. 碘酸钾溶于水的电离方程式为:KIO3===K++I—+O2—
C. 人体缺碘可引起甲状腺肿大
D. 待食品熟后加入可有效防止碘酸钾分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓度均为4.0 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的锌粉,充分反应后生成气体体积比为2∶3,则加入锌粉的质量是
A. 6.5 g B. 13.0 g C. 19.5 g D. 26.0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气脱除SO2及NOx对解决雾霾污染很重要,脱硫脱硝的方法很多,一种ClO2气相氧化法反应机理和速率常数(K)如下:
脱硝:①NO(g)+ ClO2(g)= NO2(g)+ ClO(g) △H1 k1=l.7×1011mL·(mol·s)-1
②NO(g)+ ClO(g)= NO2(g)+Cl(g) △H2 k2=8.8×1012 mL·(mol·s)-1
脱硫:③SO2(g)+ClO2(g)=SO3(g)+ClO(g) △H3 k3=2.1×10-4 mL·(mol·s)-1
④SO2(g)+ClO(g)=SO3(g)+ Cl(g) △H 4 k4=6.9×1011 mL·(mol·s)-1
两过程中产生的Cl可与ClO2进一步反应,如:
⑤C1(g)+ClO2(g)=2ClO(g) △H5
(1)同时脱硫脱硝反应NO(g)+SO2(g)+2ClO2(g)=NO2(g)+SO3(g)+ 2ClO(g)的反应热最简表达式△H=____________。
(2)己知反应③④的速率方程分別为v正=k3·c (SO2) · c (ClO2)、v正=k4·c (SO2) · c (ClO),试判断两反应的活化能大小,E3____________E4(填“>”“<”或“=”)。控制脱硫速度的关键步骤是____________反应(填③或④)
(3)SO2、NO单独氧化及同时氧化对两气体氧化率变化如图,同时氧化对____________气体的氧化率影响明显,结合①③④反应及其速率常数分析原因____________。

(4)气相中水蒸气含量提高,SO2单独氧化率会迅速提升,并生成两种常见的酸,请写出该过程化学反应方程式__________________________________。
(5)“湿式吸收法”利用吸收剂与SO2发生反应从而达脱硫目的。
①下列适合作该法吸收剂的是____________(填序号)。
A.氨水 B. Na2SO4溶液 C. Na2CO3 溶液D. NaHSO4溶液
②用石灰水也可吸收SO2,生成亚硫酸钙浊液。
计算 CaSO3(s)+H+(aq)![]() Ca2+(aq)+HSO3-(aq)的平衡常数K=____________。25℃时,H2SO3电离常数为:K1=1.41×10-2,K2=6.30×10-8 Ksp=6.76×10-3
Ca2+(aq)+HSO3-(aq)的平衡常数K=____________。25℃时,H2SO3电离常数为:K1=1.41×10-2,K2=6.30×10-8 Ksp=6.76×10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH=________(填“<”、“>”或“=”)0。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=________mol·L-1,C的物质的量为________mol;若反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol 氩气,平衡时A的转化率为________。
(3)判断该反应是否达到平衡的依据为________。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1200 ℃时,反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com