
实验室需用480 mL 0.1mol/L的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作能配制成功的是
A.称取7.68g CuSO4粉末,加入500 mL水
B.称取8g CuSO4·5H2O晶体,加水配成500 mL溶液
C.称取8g CuSO4粉末,加入500 mL水
D.称取12.5g CuSO4·5H2O晶体,加水配成500 mL溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年河南省高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法或表示方法正确的是
A.反应物总能量低于生成物总能量时,该反应不能发生
B.强酸跟强碱反应放出的热量称为中和热
C.由石墨比金刚石稳定可知,C(石墨,固)=C(金刚石,固)△H>O
D.在101kPa、25℃时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式表示为:2H2(g)十02(g)=2H2O(l);△H=-285.8KJ/mol
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期10月第一次月考化学试卷(解析版) 题型:选择题
下列关于氯的说法正确的是
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.实验室制备Cl2可用排饱和食盐水集气法收集
C.液氯、氯水均为含多种分子和离子的混合物
D.1.12 L Cl2含有1.7NA个质子(NA表示阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上学期第一次月考化学试卷(解析版) 题型:选择题
已知水和苯不互相溶,苯不与钠反应,在烧杯中加水和苯(密度:0.88 g/mL)各50 mL。将一小粒金属钠(密度:0.97 g/mL)投入烧杯中,观察到的现象可能是
A.钠在水层中反应并四处游动
B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动
D.钠在苯与水的界面处反应,可能做上下跳动
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西大学附属中学高一上学期第一次月考化学试卷(解析版) 题型:填空题
(10分)下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
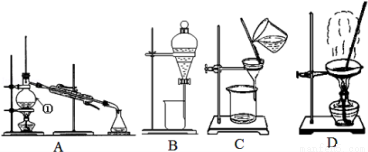
(1)从氯化钠溶液中得到氯化钠固体,选择装置 (填代表装置图的字母,下同);除去自来水中的Cl﹣等杂质,选择装置 ;从碘水中分离出I2,选择装置 ,该分离方法的名称为 。
(2)装置A中①的名称是 ,冷却水的方向是______________,温度计水银球的位置是在 ;装置B在分液时装置中的液体不能顺利滴下,原因是______________________。
(3)从碘水中得到碘时,不能选用的试剂是____________
A.酒精 B.苯 C.四氯化碳
若选则试剂X(密度小于水的密度)从碘水中提取碘时,充分振荡、静置后,下层液体的颜色为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.可逆反应不可以自发进行
B.催化剂可以加块反应速率,也可增大反应物的转化率
C.当有多个反应参加时,使用催化剂,可增加目标产物的产率
D.H2与O2点燃生成H2O,H2O电解产生H2与O2,说明该反应可逆
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期9月月考化学试卷(解析版) 题型:填空题
(14分)铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H=+116.0kJ·mol-1
热化学方程式:Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) △H= kJ·mol-1。
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4 + 3H3PO2 + 6H2O = 4CuH↓ + 4H2SO4 + 3H3PO4
①该反应还原剂是 (写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为 mol。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如右图所示。

①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
(4)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。

查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期10月月考化学试卷(解析版) 题型:选择题
向一盛有22.4L(标准状况下)CO2和CO混合气体的密闭容器中投入1molNa2O2固体,用间断的电火花引发至充分反应,下列对反应完全后容器里剩余固体的叙述正确的是()
A.1molNa2CO3
B.0.5molNa2CO3,0.5molNa2O2
C.0.25molNa2CO3,0.75molNa2O2
D.0.75molNa2CO3,0.25molNa2O2
查看答案和解析>>
科目:高中化学 来源:2016届安徽省安庆市高三上学期第一次质检化学试卷(解析版) 题型:简答题
工业上可利用“甲烷蒸气转化法生产氢气”,反应为:
CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷平衡含量(%)的影响如下图1:

图1 (水碳比为3) 图2 (800℃)
(1)CH4(g)+H2O(g)  CO(g)+3H2(g)。的
CO(g)+3H2(g)。的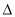 H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向正应方向”、“向逆反应方向”或“不”)。
H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向正应方向”、“向逆反应方向”或“不”)。
(2)温度对该反应的反应速率和平衡移动的影响是 。
(3)其他条件不变,请在图2中画出压强为2MPa时,甲烷平衡含量(%)与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(4)已知:在700℃,1MPa时,1mol CH4与1mol H2O在2L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com