
����Ŀ�����������(H2NCOONH4)��һ���ֽ⡢��ˮ��İ�ɫ������ij�о�С�����������ƹ��塢Ũ��ˮ���ɱ���Ϊԭ���Ʊ���������淋�ʵ��װ����ͼ��ʾ������Ҫ��Ӧ��ԭ��Ϊ2NH3(g)+CO2(g)![]() NH2COONH4(s) ��H<O��
NH2COONH4(s) ��H<O��
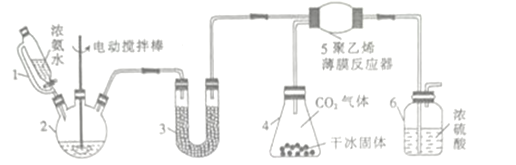
��1������2��������________������3��ʢװ�Ĺ�����_________����������______________��
��2������6��һ�������ǿ���ԭ��������Ӧ����ϵ����ַ�Ӧ������Ӧ���ڹ۲쵽װ����Ũ�����в������ݣ���Ӧ��______________(�����ӿ����� �������������ı���)�������������ʡ�
��3����һ���Ʊ��������ᰱ�ķ�Ӧװ��(Һ��ʯ����CCl4���䵱���Խ���)��ͼ��ʾ��
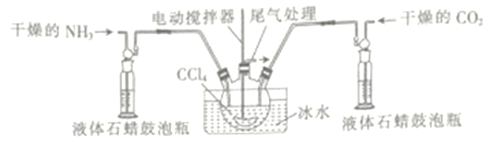
��Һ��ʯ������ƿ��������_____________________ ��
�����ޱ�ˮ�����������ֽ���������[CO(NH)2]2��д��������������ȷֽ�Ļ�ѧ����ʽ��_______________________��
�۵�CCl4Һ���в����϶ྦྷ��������ʱ������ֹͣ��Ӧ�����˷���õ��ֲ�Ʒ��Ϊ�˽����ôֲ�Ʒ�������ɲ�ȡ�ķ�����_______________(����ĸ)��
A.���� B.����Ⱥ�� C.��ѹ���Ⱥ��
��4���Ƶõİ���������п��ܺ���̼�������̼����е�һ�ֻ���������(�����ǰ����������ˮ�ķ�Ӧ)��
����Ʒ������гɷ�̽��������д���пո�
��ѡ�Լ�������ˮ��ϡ������BaCl2��Һ������ʯ��ˮ��AgNO3��Һ��ϡ���ᡣ
ʵ�鲽�� | Ԥ������ͽ��� |
����1��ȡ����������Ʒ���Թ�������������ˮ�������ܽ� | �õ���ɫ��Һ |
����2�����Թ��м��������BaCl2��Һ������ | ����Һ������ǣ���֤�������в���̼��� |
����3�����Թ��м�������___________ | _____________________________�� ��֤�������к���̼����� |
�ڸ��ݢٵĽ�����ȡ15.8g�������ᰱ��Ʒ������������������Һ��ִ�����������ϴ�ӡ������ó�������Ϊ1.97g������Ʒ�а�������淋���������Ϊ_________________��
���𰸡� ������ƿ ��ʯ�� ���ﰱ������ֹ����5�����ɵİ��������ˮ�� �ӿ� ͨ���۲����ݣ�����NH3��CO2��ͨ�����(��ͨ���۲����ݣ�����ͨ��NH3��CO2������) H2NCOONH4![]() CO(NH2)2+H2O B ��������ʯ��ˮ ����Һ����� 0.95(��95%)
CO(NH2)2+H2O B ��������ʯ��ˮ ����Һ����� 0.95(��95%)
����������1������2Ϊ������ƿ�����ڰ����������ˮ����U�����������Ƹ��ﰱ������ֹ���ɵİ��������ˮ�⣻�ʴ�Ϊ��������ƿ�����ﰱ������ֹ���ɵİ��������ˮ�⣻
��2������Ӧ���ڹ۲쵽װ����ϡ������Һ�в������ݣ�˵���ж�����̼�ų���ͨ�백���������㣬Ӧ���ʵ��ӿ�������������٣��ʴ�Ϊ���ӿ죻
��3����Һ��ʯ������ƿ�������ǣ�ͨ���۲����ݣ�����NH3��CO2��ͨ�����(��ͨ���۲����ݣ�����ͨ��NH3��CO2������) ���ڰ����������ֽ��������غ�ˮ������ʽΪ�� H2NCOONH4![]() CO(NH2)2+H2O������Ϊ������������ȷֽ⣬���Բ����ø��£�����ѡB��
CO(NH2)2+H2O������Ϊ������������ȷֽ⣬���Բ����ø��£�����ѡB��
��4���ټ��鰱������刺��ܺ���̼����李�̼����е�һ�ֻ�����,ʵ�����Ϊȡ����������Ʒ���Թ���,��������ˮ�������ܽ�,���Թ��м��������BaCl2��Һ������Һ������ǣ�֤�������в���̼��泥�ȡ�Թ��е��ϲ���Һ���μӳ���ʯ��ˮ������Һ����ǣ�֤�������к���̼����泥��ʴ�Ϊ��
ʵ�鲽�� | Ԥ������ͽ��� |
����3:��������ʯ��ˮ | ��Һ����� |
�����մﵽ����Ϊ̼�ᱵ��̼�ᱵ���ʵ���Ϊ![]() ������̼Ԫ���غ��֪̼����淋�����Ϊ0.01mol����ɵ���Ʒ�а�������淋�����Ϊ15.8g0.01mol��79g/mol=15.01g������Ʒ�а�������淋�����Ϊ
������̼Ԫ���غ��֪̼����淋�����Ϊ0.01mol����ɵ���Ʒ�а�������淋�����Ϊ15.8g0.01mol��79g/mol=15.01g������Ʒ�а�������淋�����Ϊ![]() ���ʴ�Ϊ��95%��
���ʴ�Ϊ��95%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
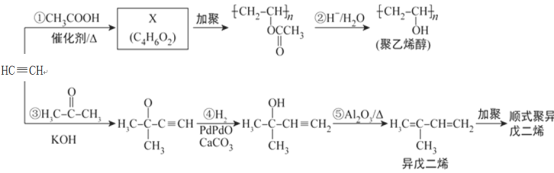
����Ŀ����Ȳ�ǻ����л�����ԭ�ϣ�����Ȳ�Ʊ�����ϩ����˳ʽ�������ϩ�ĺϳ�·�ߣ����ַ�Ӧ������ȥ����ͼ��ʾ��
�ش��������⣺
��1����ϵͳ���������������ϩ��________________________________________��
��2��X�����к��еĹ�����������________________________________________��
��3����Ӧ��~���У�__________���Ӧ��ţ��ķ�Ӧ�����뷴Ӧ�ܲ�ͬ����Ӧ������__________��Ӧ��
��4������Ȳ������ͬ�����ŵ������ϩ��ͬ���칹�干��__________�֡�
��5��X������ͬ���칹��������һ�ֱ�����������ʾ���źţ������ݣ���ȫ��ͬ����������__________��ѡ����ĸ����
a�������� b����������� c��Ԫ�ط����� d���˴Ź�����
��6��˳ʽ�������ϩ�Ľṹʽ�ǣ�ѡ����ĸ��__________��
a��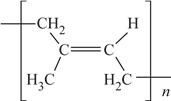 b��
b��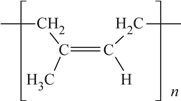
c��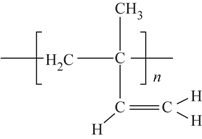 d��
d��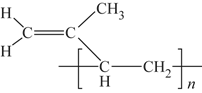
��7�����������ϩ�������ϳ�·�ߣ����һ������ϩ����ȩΪ��ʼԭ���Ʊ�1��3-����ϩ�ĺϳ�·�ߣ�_________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ϡ������ͭ��Ӧ�Ʊ�NO���壬�������ͼ��װ��(��ƿ�ڼ���ϡ�����ͭƬ����Ҫʱ�ɼ���)��ʵ��Ч������ʮ�����룬��Ϊ�۲쵽������������֤����Ӧ������NO�����������ͼ��װ��(��Ƥ���¶�����ͭ˿Ȧ)����������ʵ����Դﵽ�����Ч����
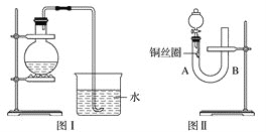
(1)��ͼ��װ����ʵ��ʱ������ˮ���ռ������������ɫΪ_____ɫ��ʵ�����������______�����۲쵽____________���ɣ��Ӷ���������֤����Ӧ������NO��
(2)��ͼ��װ����ʵ��ʱ�����йز���������ȫ��
�ٽ���Һ©���Ļ�������U�ιܵ�B��ܿ�ע��ϡ���ᣬһֱע��____________Ϊֹ��
�ڹرջ������þƾ�����U�ιܵ�A����ȣ���______ʱ��������ȥ�ƾ��ơ�
(3)����ͼ��װ�õ�ʵ������������⣺
�ٷ�Ӧ��ʲô����¿����Զ�ֹͣ��________________________��
���ںδ��۲쵽��ɫ��NO���壿____________________________________________��
���������Һ©���Ļ����������������۲쵽��Щ��������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ӻ�Br-�ķ�Һ����ȡ�嵥�ʣ��辭��һϵ�в�����ʵ��װ�ü����ʵ�����������

Br2 | CCl4 | ��ʮ���� | |
�ܶ�/g��cm-3 | 3. 12 | 1.59 | 0.753 |
�е�/�� | 58.76 | 76.8 | 215��217 |
����˵������ȷ����
A. ����װ�ü�������Һ�е�Br-
B. װ������ѡ����ʮ���������CCl4������Ϊ��ʮ������ܶȸ�С
C. ��װ�ñ������������ռ���ʮ�������ռ�Br2
D. ��װ�ö���������Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������ʱ����ɫ�겣�������������ɫ��˵����������һ�����У�������
A.��ԭ��
B.������
C.��Ԫ��
D.�صĻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ��д�����Mg2����Al3����H����Cl��������OH���������Һ����μ���0.5 mol��L��1NaOH��Һ�����ɳ����������ͼ���NaOH��Һ�����֮��Ĺ�ϵ����ͼ��ʾ������ж�ԭ��Һ��(����)
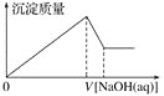
A. ��Mg2����û��Al3��
B. ��Al3����û��Mg2��
C. ��Mg2����Al3��
D. �����H����Mg2����Al3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ժ��ܷϴ���(��Ҫ�ɷ�ΪCo��Fe��SiO2)Ϊԭ����ȡ���������ܵ�����������
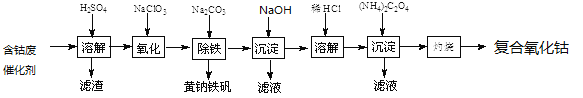
��1����H2SO4�ܽ��������õ���������_________(�ѧʽ)��������ϴ��2��3�����ٽ�ϴҺ����Һ�ϲ���Ŀ����____________________��
��2���ڼ��Ƚ��������¼���NaClO3����Fe2+������Fe3+����Ӧ�����ӷ���ʽ��___________________��
��3����֪�����軯�صĻ�ѧʽΪK3[Fe(CN)6]�������軯�صĻ�ѧʽΪK4[Fe(CN)6]��
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2��(��ɫ����)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3��(��ɫ����)
ȷ��Fe2+�Ƿ�������ȫ�ķ�����__________________��(����ѡ����Լ������軯����Һ�������軯����Һ���ۡ�KSCN��Һ)
��4�������������Һ�м���������Na2CO3������ȣ�ʹ֮���ɻ�������[Na2Fe6(SO4)4(OH)12]������д���÷�Ӧ�����ӷ���ʽ��_______________________��
��5�����������ĵ���ƽ�ⳣ���ĸ���������pK��ʾ�������±��������ж�(NH4)2C2O4��Һ�и����ӵ�Ũ���ɴ�С��˳��Ϊ__________________��
H2C2O4 | pKa1= l.25��pKa2=4.13 |
NH3��H2O | pKb=4.76 |
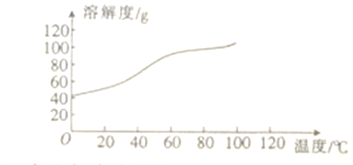
��6����֪CoCl2���ܽ��������ͼ��ʾ�����ʽ̼�����м�������ϡ������ȱ߽�������ȫ�ܽ������ȹ�����ԭ����_____________________��
��7��ȷ��ȡ1.470gCoC2O4���ڿ����г�����յ�0.814g���������ܣ�д�����������ܵĻ�ѧʽ��_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Цġ��á������־���ṹ�����������Ǧġ��á������־����ڲ�ͬ�¶���ת����ͼʾ�������й�˵���в���ȷ���� ( )

�ģ�Fe![]() �ã�Fe
�ã�Fe![]() ����Fe
����Fe
A���ģ�Fe������ÿ��Feԭ�Ӿ�������������Feԭ����8��
B���ã�Fe������ÿ��Feԭ�Ӿ�������������Feԭ����12��
C��ͼ�Ц���Fe�����߳���Ϊa cm���ģ�Fe�����߳���Ϊb cm�������־�����ܶȱ�Ϊb3:a3
D����Fe���ȵ�1 500���ֱ�����ȴ�ͻ�����ȴ���õ��ľ���������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����ɫ��������������Դ����ͼ����ɫ��Դ��������ȼ�ϵ�ء��Ĺ���ԭ��ʾ��ͼ��a ��b��Ϊ�����Pt�缫���õ�ع���ʱ������˵������ȷ����
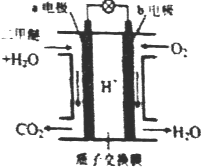
A. a�缫Ϊ�õ������
B. ��ع���ʱ��ȼ�ϵ���ڲ�H+��b�缫����a�缫
C. ��ع���ʱ��b�缫��Ӧʽ��O2+4e-+2H2O=4OH-
D. ��ع���ʱ��a�缫��Ӧʽ��CH3OCH3-12e-+3H2O=2CO2��+12H+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com