

分析 (1)①Ⅰ. H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
Ⅱ. CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
根据盖斯定律,Ⅰ×3-Ⅱ可得:CO2(g)+3H2(g)═CH3OH(g)+H2O(g),反应焓变也进行相应计算;
②根据①中分析可知,正反应为放热反应,则反应物总能量大于生成物总能量,由于气态物质的能量高于液态物质,故生成液态产物放出的热量更多;
(2)①甲醇在负极失电子发生氧化反应,A为负极,氧气在正极得到电子发生还原反应,B为正极,电子从负极经外电路流向正极;
②B电极反应是氧气得到电子生成氢氧根离子在酸性溶液中生成水,氢离子通过交换膜移向正极,氢离子物质的量不变,溶液体积变化忽略不计,溶液中氢离子浓度不变;
③A电极是原电池负极,甲醇失电子发生氧化反应,在酸溶液中生成二氧化碳,由电荷守恒可知有H+生成.
解答 解:(1)①Ⅰ. H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
Ⅱ. CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
根据盖斯定律,Ⅰ×3-Ⅱ可得:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol;
②根据①中分析可知,正反应为放热反应,则反应物总能量大于生成物总能量,由于气态物质的能量高于液态物质,故生成液态产物放出的热量更多,图象中a符合,
故答案为:a;
(2)①甲醇在负极失电子发生氧化反应,A为负极,氧气在正极得到电子发生还原反应,B为正极,电子从负极经外电路流向正极.即电子由A极经外电路流向B极,
故答案为:从A到B;
②B电极反应是氧气得到电子生成氢氧根离子在酸性溶液中生成水,氢离子通过交换膜移向正极,氢离子物质的量不变,溶液体积变化忽略不计,溶液中氢离子浓度不变,故溶液pH不变,
故答案为:不变;
③A电极是原电池负极,甲醇失电子发生氧化反应,在酸溶液中生成二氧化碳,由电荷守恒可知有H+生成,电极反应式为:CH3OH+H2O-6e-═6H++CO2↑,
故答案为:CH3OH+H2O-6e-═6H++CO2↑.
点评 本题考查热化学方程式的书写、原电池等,侧重考查学生对知识的综合应用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4△H3-6△H1-4△H2 | B. | 6△H1+4△H2-4△H3 | C. | △H1+△H2-△H3 | D. | △H3-△H1-△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丙烷和2-甲基丁烷互为同分异构体 | |
| B. | 沸点:正戊烷>正丁烷>2-甲基丙烷 | |
| C. | 分子式分别为C5H12、C9H20和C100H202的有机物一定互为同系物 | |
| D. | 含有5个碳原子的烃有三种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .C、D还可形成化合物D2C2,D2C2含有的化学键是离子键、非极性共价键(或离子键、共价键).
.C、D还可形成化合物D2C2,D2C2含有的化学键是离子键、非极性共价键(或离子键、共价键).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答: CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
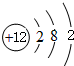 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为负极,锌发生氧化反应 | |
| B. | 铜为正极,铜不易失去电子而受到保护 | |
| C. | 外电路电子流入的一极为正极电子流出的一极为负极 | |
| D. | 负极发生还原反应,正极发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com