
【题目】下列各能层中包含f 能级的是
A. L B. N C. M D. K
科目:高中化学 来源: 题型:
【题目】关于电解池应用的规律提炼题组某化学兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题:
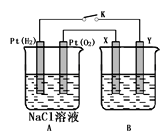
(1)通O2的Pt电极为电池__________极(填电极名称),其电极反应式为______________。
(2)若B电池为电镀池,目的是在某镀件上镀一层银,则X电极材料为_________,电解质溶液为__________。
(3)若B电池为精炼铜,且粗铜中含有Zn、Fe、Ag、Au等杂质,在__________电极(填“X”或“Y”)周围有固体沉积成阳极泥,阳极泥的成分为___________。
(4)若X、Y均为Pt,B电池的电解质溶液为500 mL 1.0mol/L的NaCl溶液,当电池工作一段时间断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全逸出,溶液体积不变)。恢复到常温下,B电池溶液的pH=___________,要使该溶液恢复到原来的状态,需加入__________(填物质并注明物质的量)。
(5)若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为_______________。
(学法题)通过以上题目,请总结书写电极反应式的关键____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确的是( )
A. 含氢元素的化合物中一定有氢键
B. 氢键比分子间作用力强,所以它属于化学键
C. DNA中的碱基互补配对是通过氢键来实现的
D. H2O是一种非常稳定的化合物,这是由于氢键所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验报告中记录下列数据,其中正确的是( )
A.用25mL量筒量取12.36mL盐酸
B.用托盘天平称量8.75g食盐
C.用500mL的容量瓶配制480mL溶液
D.用广泛pH试纸测得某溶液的pH为3.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3与NaHCO3的性质判断正确的是
A. 常温下溶解度:Na2CO3<NaHCO3
B. 热稳定性:Na2CO3<NaHCO3
C. 与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3
D. 与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入______溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数。
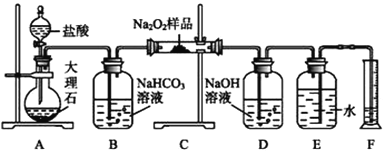
①将仪器连接好以后,必须进行的第一步操作是____________________________________。
②B装置出来的气体是否需要干燥______(填“是”或“否”)。
③D中NaOH溶液的作用____________________。
④实验结束时,读取实验中生成气体的体积时,不合理的是__________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为_____________。
⑥实验完成后E到F之间导管内残留水的体积会使测量结果________(填“偏大”“偏小”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的无机化工产品,合成氨工业对国民经济和社会发展具有重要的意义。其原理如下:N2(g)+3H2(g)![]() 2NH3 (g)ΔH<0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。
2NH3 (g)ΔH<0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。
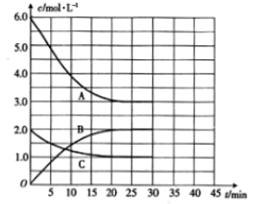
(1)表示N2浓度变化的曲线是___________(填字母),25min时c(NH3)=_________。
(2)0~25min内,用H2浓度变化表示的化学反应速率是_______________。
(3)此温度下,上述反应的平衡常数K的数值为_________________。
(4)若升高温度,则平衡向___________(填“正反应”或“逆反应”)方向移动;正反应速率_____(填“增大”“减小”或“不变”,下同),逆反应速率__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应最终没有固体析出的是( )
A.向NaHCO3溶液中加入过量澄清石灰水
B.向饱和氢氧化钠溶液中加入钠单质
C.向氯化钡溶液中通入少量SO2
D.向饱和碳酸钠溶液中通入过量CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com