
【题目】实验室需要配制0.1 mol·L-1CuSO4溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、量筒、玻璃棒、________、________以及等质量的两片滤纸。
(2)计算,应选择下列________。
A.需要CuSO4固体8 g B.需要CuSO4·5H2O晶体12.0 g
C.需要CuSO4·5H2O晶体12.5 g D.需要CuSO4固体7.7 g
(3)称量。所用砝码生锈则所配溶液的浓度会________(填“偏高”“偏低”或“无影响”)。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是____________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了________。
(6)定容,摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度。
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会________(填“偏高”“偏低”或“无影响”)。

【答案】 胶头滴管 500 mL容量瓶 AC 偏高 搅拌,加速溶解 玻璃棒 保证溶质全部转移到容量瓶 偏低
【解析】(1)依据配制500 mL 0.1 mol·L-1的硫酸铜溶液的步骤可知,配制过程中需要的仪器为:托盘天平、药匙、烧杯、量筒、玻璃棒、胶头滴管、500 mL容量瓶等;(2)实验室需配制480 mL 0.1 mol·L-1的CuSO4溶液,需要选用500 mL容量瓶,实际上配制的是500 mL 0.1 mol·L-1的硫酸铜溶液,需要硫酸铜的物质的量为:0.1 mol·L-1×0.5 L=0.05 mol,若用CuSO4配制,则需要的质量:160 g·mol-1×0.05 mol=8.0 g;若用CuSO4·5H2O配制,则需要的质量:250 g·mol-1×0.05 mol=12.5 g;(3)称量所用砝码生锈,称取的溶质的质量偏大,溶质的物质的量偏大,溶液的浓度偏高;(4)溶解固体物质,用玻璃棒搅拌可以加速固体的溶解;(5)配制一定物质的量浓度的溶液,在移液操作中应该用玻璃棒将溶液引流入容量瓶中,并洗涤烧杯2~3次,保证溶质全部转移到容量瓶,防止产生误差;(8)定容时,仰视刻度线,导致溶液的体积偏大,溶液的浓度偏低。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于金属及其化合物的说法中正确的是
A. 氧化钠和过氧化钠都属于碱性氧化物
B. 豆粒大的金属钠投入到硫酸铜溶液中,析出红色的固体物质
C. 金属钠、镁着火时,可用“干冰”进行灭火
D. 运用铝热反应原理可以冶炼金属铬、锰等难熔金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为 , K+移向 极(填A、B)

(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:①A电极附近可观察到的现象是 。
②B电极上的电极反应式为 ,总反应化学方程式是 。
③反应一段时间后打开K2 , 若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL, 将溶液充分混合,溶液的pH约为 。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 。
(3)如要用电解方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 ,电极反应式是 ,反应一段时间后电解质溶液中Cu2+浓度 (填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(7分)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48L混合气体通过足量的溴水,结果溴水增重3.36g,求原混合气体中各烃的体积分数。 (注:此题必须写出过程,否则不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分〕某化学兴趣小组欲探究含硫物质的性质及制备。
【探究一】用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
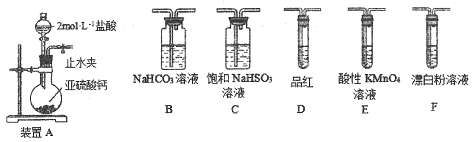
装置连接顺序为_________(用字母表示),其中装置C的作用是___________。
【探究二】
(1)某小组同学为探究SO2的漂白性性质,用下图所示装置进行实验,
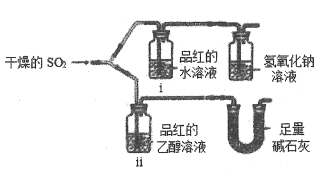
观察到如下现象:i中红色褪去;ii中无变化.碱石灰的作用除了吸收尾气外还有_______的作用。从实验中可知使品红的水溶液褪色的微粒可能是____________。
(2)该小组同学又对SO2与氯水的反应进行探究。
①用注射器吸入一定量的饱和氯水和SO2,振荡,静置,再吸入少量品红溶液,发现品红溶液不褪色。②改变氯水用量,重复①操作,发现品红溶液红色褪去,你认为②中品红溶液褪色的原因可能是__________。 设计一个实验(说明操作方法、现象及结论)来验证你的假设________。
【探究三】连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。制取保险粉通常需要二氧化硫。
(1)制取Na2S2O4常用甲酸钠法。控制温度70-80℃,在甲醇溶液(溶剂)中溶解甲酸钠(HCOONa),再滴加Na2CO3溶液同时通SO2维持溶液酸性,即可生成Na2S2O4,反应的离子方捏式________。
(2)测定保险粉纯度。Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O。称取5.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于锥形瓶中,用0.10mol·L-1的KMnO4溶液滴定。重复上述操作2次,平均消耗KMnO4溶液21.00mL.则该样品中Na2S2O4的质量分数为______ (杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F是一种橡胶,具有高弹性、耐寒性和耐磨损性能,X是一种合成树脂,二者的工业合成路线如下图所示。

已知:I.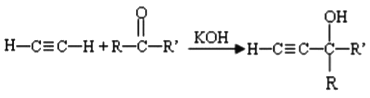
II.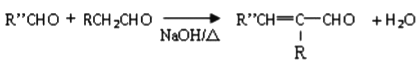
(-R、-R′、-R′′表示可能相同或可能不同的原子或原子团)
(1)①反应的类型为_______。
(2)E的系统命名为________,其分子中最多有______个原子共平面。
(3)A分子中核磁共振氢谱的吸收峰只有1组,C的结构简式为_______。
(4)关于D的说法不正确的是______。
a.分子式为C5H12O
b.可被氧化成醛类
c.官能团含有碳碳双键和羟基
d.能够发生加成、消去、取代、聚合等反应
(5)H存在顺反异构,其反式结构简式为_____, H的同分异构体中属于芳香族化合物的共有_______种。
(6)B与FeCl3溶液作用显紫色。B与G在一定条件下反应生成X的化学方程式为________。
(7)已知: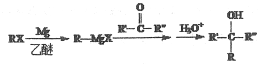 (R、R′、R′′代表烃基或氢)
(R、R′、R′′代表烃基或氢)
结合本题信息,以乙醇为原料,无机试剂任选,写出合成CH3CH=CHCH(OH)CH2CH3的路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 常温下,5.6g Fe与含0.2mol HNO3的溶液充分作用,最少会失去电子数为0.15NA
B. 3g![]() 所含的电子数为1.8NA
所含的电子数为1.8NA
C. 常温下,1L 0.1mol/L AlCl3溶液中阳离子数目小于0.1NA
D. 15.6g Na2O2 和Na2S的固体混合物中,含有阴离子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。请回答下列问题:
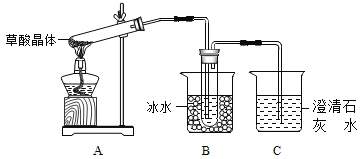
(1)甲组同学按照上图所示装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是_______,由此可知草酸晶体分解的产物中有__________。装置B的主要作用是_____________。
(2)乙组同学认为草酸晶体分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
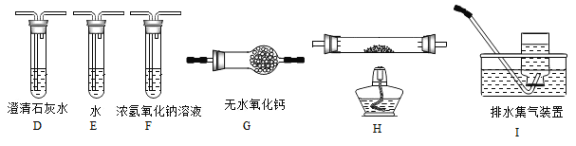
①乙组同学的实验装置中,依次连接的合理顺序为A、B_____________。
装置H反应管中盛有的物质是_________________。
②能证明草酸晶体分解产物中有CO的现象是_________________。
(3)设计实验证明:
①草酸的酸性比碳酸的强_____________。
②草酸为二元酸___________________。
(4)草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4溶液、MnO2氧化,锰元素被还原为+2价。KMnO4溶液和草酸钠溶液在稀硫酸中反应的离子方程式为:________________。
实验室常用固体草酸钠测定KMnO4溶液的浓度。准确称取0.2000g草酸钠,放入锥形瓶中,加入100mL稀硫酸溶解,用配制好的KMnO4溶液滴定,三次重复实验消耗KMnO4溶液的体积分别是16.02mL、16.00 mL、16.01 mL,则KMnO4溶液的物质的量浓度的计算式是:c(KMnO4)=_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com