
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 常温下,5.6g Fe与含0.2mol HNO3的溶液充分作用,最少会失去电子数为0.15NA
B. 3g![]() 所含的电子数为1.8NA
所含的电子数为1.8NA
C. 常温下,1L 0.1mol/L AlCl3溶液中阳离子数目小于0.1NA
D. 15.6g Na2O2 和Na2S的固体混合物中,含有阴离子数目为0.3NA
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497 kJ·mol-1,N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol-1。则相同条件下破坏1molNO中化学键需要吸收的能量为_______kJ。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=____ kJ·mol-1;若加入少量NaOH固体,则溶液中 _____(填“增大”、“减小”或“不变”)。
_____(填“增大”、“减小”或“不变”)。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其含碳元素的微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________。溶液中各种离子的物质的量浓度大小关系为______________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=______。
HCO3-+OH-的平衡常数Kh=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.1 mol·L-1CuSO4溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、量筒、玻璃棒、________、________以及等质量的两片滤纸。
(2)计算,应选择下列________。
A.需要CuSO4固体8 g B.需要CuSO4·5H2O晶体12.0 g
C.需要CuSO4·5H2O晶体12.5 g D.需要CuSO4固体7.7 g
(3)称量。所用砝码生锈则所配溶液的浓度会________(填“偏高”“偏低”或“无影响”)。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是____________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了________。
(6)定容,摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度。
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会________(填“偏高”“偏低”或“无影响”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。基态Cr原子中,电子占据最高能层的符号为________,该能层上具有的原子轨道数为________,电子数为________。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律?________(填“是”或“否”),原因是_______________________________(如果前一问填“是”,此问可以不答)。
(3)镓与第ⅤA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如下图所示(白色球代表As原子)。在GaAs晶体中,每个Ga原子与________个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为________。
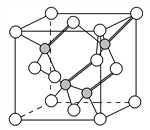
(4)与As同主族的短周期元素是N、P、AsH3中心原子杂化的类型________;一定压强下将AsH3和NH3、PH3的混合气体降温时首先液化的是________,理由是________________________。
(5)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;设晶胞边长为a cm,阿伏加德罗常数的值为NA,该晶体的密度为________ g·cm-3(用含a和NA的式子表示)。
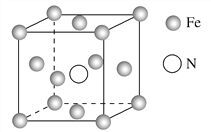
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】该有机物 HOCH2—CH2—CH=CHBr 能发生以下反应中的( )种。
①与 AgNO3 溶液生成淡黄色沉淀 ②加聚反应 ③消去反应 ④使酸性 KMnO4 溶液褪色 ⑤取代反应 ⑥使溴水褪色 ⑦催化氧化反应
A.4B.5C.6D.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法错误的是
A. 氢氧化铁胶体可用于净水 B. Fe2O3可用作红色涂料
C. 纯碱溶液可用于去除油污 D. MnO2和浓HCl可用于工业制氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是中学实验室常用的试剂。
(1)写出氯化铁在水中的电离方程式:_________。
(2)利用氯化铁溶液制备氢氧化铁胶体。
①下列制备氢氧化铁胶体的操作方法正确的是_______(填字母)。
A.向饱和氯化铁溶液中滴加适量的氢氧化钠稀溶液
B.加热煮沸氯化铁饱和溶液
C.在氨水中滴加氯化铁浓溶液
D.在沸水中滴加饱和氯化铁溶液,煮沸至出现红褐色液体
②区别氯化铁溶液和氢氧化铁胶体的方法是___________。
(3)为了探究离子反应的本质,设计如下实验:
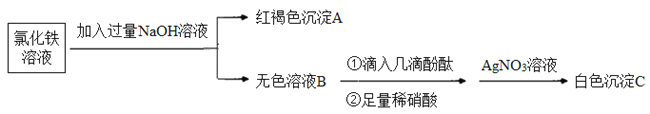
①写出生成A的离子方程式:_________。
②上述流程中,加入足量稀硝酸的目的是________。如何判定无色溶液B与稀硝酸发生了离子反应?________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验过程或事实的反应方程式不正确的是
A. 熔融烧碱时,不能使用普通石英坩埚:
SiO2+2NaOH ![]() Na2SiO3+H2O
Na2SiO3+H2O
B. 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:
2I-+H2O2+2H+=I2+O2↑+2H2O
C. 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:
3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
D. “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:
ClO-+Cl-+2H+=Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业上常用CO和H2合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) △H
CH3OH(g) △H
①已知:aA(g)+bB(g)=xX(g)+yY(g) △H=x△Hm[X(g)]+y△Hm[Y(g)]-a△Hm[A(g)]-b△Hm[B(g)]。
△Hm[X(g)]表示X(g)的摩尔生成焓,其余类推。25℃101kPa时,CO(g)、H2(g)、CH3OH(g)的摩尔生成焓分别为-110.5kJ·mol-1、0、-201.2kJ·mol-1,则上述反应的△H=_____。
②某温度下,向容积为2L的密闭容器中加入1molCO和2molH2,发生上述反应,CO转化率随时间的变化如图所示:
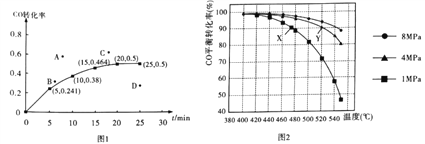
该温度下反应的平衡常数为_______;若起始压强为9MPa,则10min时容器中的压强为_______;若保持其它条件不变,起始时加入2molCO和2molH2,达到平衡,相应的点可能是上图A、B、C、D中的____。
③若只改变反应的一个条件,能使平衡体系中![]() 增大的措施有_______________(答出两点即可)。
增大的措施有_______________(答出两点即可)。
④若投料时CO与H2的物质的量之比恒定,温度、压强对CO平衡转化率的影响如图所示,如图中X点的v(逆)____________Y点的v(正)(填“>”“<”或“=”),理由是_____________。
(2)工业上常用CH3OH来制备HCOOH(甲酸)。已知25℃时,0.1mol·L-1HCOOH溶液的pH为2.3,则甲酸的电离度计算式为______;向0.1mol·L-1HCOOH溶液中加水或加入少量HCOONa晶体时,会引起同样变化的是_______(填编号)。
A.溶液的pH增大 B.HCOOH的电离程度增大
C.溶液的导电能力减弱 D.溶液中c(OH-)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com