
����Ŀ�����������е�18��Ԫ�ؾ�����Ҫ����;�����ִ���ҵ�б���������
(1)����һ��Ӳ���ࡢ����ʴ��ǿ�Ľ����������ڵ�ƺ��������ָ֡���̬Crԭ���У�����ռ������ܲ�ķ���Ϊ________�����ܲ��Ͼ��е�ԭ�ӹ����Ϊ________��������Ϊ________��
(2)��������Ԫ�صĵ�һ��������ԭ��������������������������ģ�30Zn��31Ga�ĵ�һ�������Ƿ������һ���ɣ�________(��ǡ���)��ԭ����_______________________________(���ǰһ����ǡ������ʿ��Բ���)��
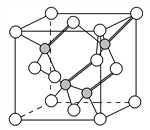
(3)����ڢ�A��Ԫ�ؿ��γɶ��������˹��뵼����ϣ��黯��(GaAs)��������һ�֣��侧��ṹ����ͼ��ʾ(��ɫ�����Asԭ��)����GaAs�����У�ÿ��Gaԭ����________��Asԭ����������ͬһ��Gaԭ��������Asԭ�ӹ��ɵĿռ乹��Ϊ________��
(4)��Asͬ����Ķ�����Ԫ����N��P��AsH3����ԭ���ӻ�������________��һ��ѹǿ�½�AsH3��NH3��PH3�Ļ�����彵��ʱ����Һ������________��������________________________��
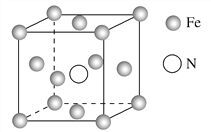
(5)���Ķ��ֻ������Ϊ���Բ��ϣ�������������һ�֣�ij�������ľ����ṹ��ͼ��ʾ�������Ļ�ѧʽΪ________���辧���߳�Ϊa cm�������ӵ�������ֵΪNA���þ�����ܶ�Ϊ________ g��cm-3(�ú�a��NA��ʽ�ӱ�ʾ)��
���𰸡� N 16 1 �� 30Zn��4s�ܼ�����ȫ����״̬�����ȶ� 4 �������� sp3 NH3 ��Ϊ�����Ӽ������������Ӽ����������е���ߣ�����ʱ��Һ�� Fe4N 238/(a3NA)
��������������Ҫ���龧��ṹ��
(1)��̬Crԭ���У�����ռ������ܲ�ķ���ΪN�����ܲ��Ͼ��е�ԭ�ӹ��Ϊ4s��4p��4d��4f�������Ϊ16��������Ϊ1��
(2)��ԭ����30Zn��4s�ܼ�����ȫ����״̬�����ȶ���
(3)��GaAs�����У�ÿ��Gaԭ����4��Asԭ����������ͬһ��Gaԭ��������Asԭ�ӹ��ɵĿռ乹��Ϊ�������塣
(4)��Asͬ����Ķ�����Ԫ����N��P��AsH3����ԭ�ӵļ۲���Ӷ�����4���ӻ���������sp3��һ��ѹǿ�½�AsH3��NH3��PH3�Ļ�����彵��ʱ����Һ������NH3����������Ϊ�����Ӽ������������Ӽ����������е���ߣ�����ʱ��Һ����
(5)�������Ļ�ѧʽΪFe4N���þ�����ܶ�Ϊ238/(a3NA)g��cm-3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ��Ϻ��ã������ֲַ���ǣ� ��
A. �Ҵ� B. �� C. ���ȼ��� D. ���Ȼ�̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ���칹��������һ�ֱ�����������ʾ���źţ������ݣ���ȫ��ͬ�����������
A.������B.���������C.Ԫ�ط�����D.�˴Ź�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����14�֡�ij��ѧ��ȤС����̽���������ʵ����ʼ��Ʊ���
��̽��һ���������װ�ú�ҩƷ̽��������������������ǿ����
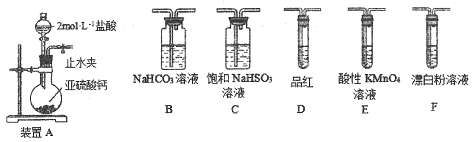
װ������˳��Ϊ_________������ĸ��ʾ��������װ��C��������___________��
��̽������
��1��ijС��ͬѧΪ̽��SO2��Ư�������ʣ�����ͼ��ʾװ�ý���ʵ�飬
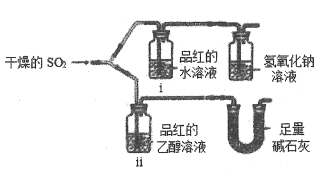
�۲쵽��������i�к�ɫ��ȥ��ii���ޱ仯����ʯ�ҵ����ó�������β�����_______����������ʵ���п�֪ʹƷ���ˮ��Һ��ɫ����������____________��
��2����С��ͬѧ�ֶ�SO2����ˮ�ķ�Ӧ����̽����
����ע��������һ�����ı�����ˮ��SO2�������ã�����������Ʒ����Һ������Ʒ����Һ����ɫ���ڸı���ˮ�������ظ��ٲ���������Ʒ����Һ��ɫ��ȥ������Ϊ����Ʒ����Һ��ɫ��ԭ�������__________�� ���һ��ʵ�飨˵�����������������ۣ�����֤��ļ���________��
��̽������������������(Na2S2O4)�׳Ʊ��շ����㷺���ڷ�֯��ҵ�Ļ�ԭ��Ⱦɫ����ϴ��ӡ������ɫ�Լ�֯���Ư�ȡ���ȡ���շ�ͨ����Ҫ��������
��1����ȡNa2S2O4���ü����Ʒ��������¶�70-80�棬�ڼ״���Һ���ܼ������ܽ�����ƣ�HCOONa�����ٵμ�Na2CO3��ҺͬʱͨSO2ά����Һ���ԣ���������Na2S2O4����Ӧ�����ӷ���ʽ________��
��2���ⶨ���շ۴��ȡ�Na2S2O4����ǿ��ԭ������¶�ڿ������ױ�����������Na2S2O4��KMnO4������Һ������Ӧ��5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O����ȡ5.0g Na2S2O4��Ʒ������ˮ��,���100mL��Һ,ȡ��10mL����Һ����ƿ�У���0.10mol��L-1��KMnO4��Һ�ζ����ظ���������2����ƽ������KMnO4��Һ21.00mL.�����Ʒ��Na2S2O4����������Ϊ______ �����ʲ����뷴Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��F��һ�������иߵ��ԡ��ͺ��Ժ���ĥ�����ܣ�X��һ�ֺϳ���֬�����ߵĹ�ҵ�ϳ�·������ͼ��ʾ��

��֪��I.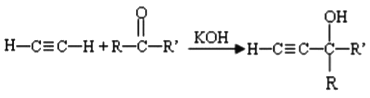
II.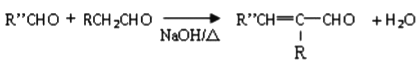
(-R��-R�䡢-R�����ʾ������ͬ����ܲ�ͬ��ԭ�ӻ�ԭ����)
��1���ٷ�Ӧ������Ϊ_______��
��2��E��ϵͳ����Ϊ________��������������______��ԭ�ӹ�ƽ����
��3��A�����к˴Ź����������շ�ֻ��1�飬C�Ľṹ��ʽΪ_______��
��4������D��˵������ȷ����______��
a������ʽΪC5H12O
b���ɱ�������ȩ��
c�������ź���̼̼˫�����ǻ�
d���ܹ������ӳɡ���ȥ��ȡ�����ۺϵȷ�Ӧ
��5��H����˳���칹���䷴ʽ�ṹ��ʽΪ_____, H��ͬ���칹�������ڷ����廯����Ĺ���_______�֡�
��6��B��FeCl3��Һ��������ɫ��B��G��һ�������·�Ӧ����X�Ļ�ѧ����ʽΪ________��
��7����֪��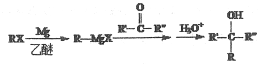 (R��R�䡢R���������������)
(R��R�䡢R���������������)
��ϱ�����Ϣ�����Ҵ�Ϊԭ�ϣ����Լ���ѡ��д���ϳ�CH3CH=CHCH(OH)CH2CH3��·��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽����Һ������������Ũ�ȵĹ�ϵ��ij����С�����������ʵ�飺
ȡһ������Ba(OH)2��Һ��������ʵ�飬���ձ��еμ�ϡ���ᡢװ����ͼ1.�����Һ����ǿ����ͼ2��ʾ��
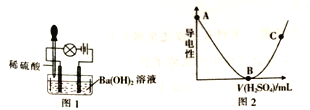
��1��������ɷ��ࡢ���η�Ϊ���Σ���Na2CO3������ʽ�Σ���NaHCO3������ʽ��[���ʽ̼��ͭCu2(OH)2CO3��]��NaHSO4����___________������ĸ����
A.���� B.������ C.��ʽ�� D.������
��2�����ձ��еμ�ϡ����Ĺ����У��۲쵽���ݱ仯����������Ϩ���������ɹ۲쵽��������_________��
��3��ͼ2�У�AB�α仯��ԭ����__________��BC�α仯��ԭ����_________��
��4��д��A��B�����з�����Ӧ�����ӷ���ʽ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ����
A. �����£�5.6g Fe�뺬0.2mol HNO3����Һ������ã����ٻ�ʧȥ������Ϊ0.15NA
B. 3g![]() �����ĵ�����Ϊ1.8NA
�����ĵ�����Ϊ1.8NA
C. �����£�1L 0.1mol/L AlCl3��Һ����������ĿС��0.1NA
D. 15.6g Na2O2 ��Na2S�Ĺ��������У�������������ĿΪ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵķ����������Ӧ�þ���ȷ����
A. SO2��Cl2����ʹƷ����Һ��ɫ�����ߵ������Ͽ�����ǿƯ������
B. Na2O2�Ǽ������������ǿ�����Կ�����ɱ������
C. MgO��Al2O3���۵�ܸߣ����߶��������������²���
D. Al(OH)3��һ��ǿ��������ᷴӦ��������ҽ�õ�θ���кͼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϊͬ���칹������ʲ�����
A.������ͬ����Է�������B.������ͬ���ۡ��е�
C.������ͬ�ķ���ʽD.������ͬ�����Ԫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com