
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497 kJ·mol-1,N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol-1。则相同条件下破坏1molNO中化学键需要吸收的能量为_______kJ。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=____ kJ·mol-1;若加入少量NaOH固体,则溶液中 _____(填“增大”、“减小”或“不变”)。
_____(填“增大”、“减小”或“不变”)。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其含碳元素的微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________。溶液中各种离子的物质的量浓度大小关系为______________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=______。
HCO3-+OH-的平衡常数Kh=______。
【答案】 631.5 10-9 不变 不能 HCO3- c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-) 10-4
【解析】(1)根据N2、O2分子中化学键的键能分别是946kJmol-1、497kJmol-1以及反应N2(g)+O2(g)=2NO(g)△H=+180kJmol-1可设NO分子中化学键的键能为X,则有:946kJmol-1+497kJmol-1-2X=180kJmol-1 得:X=631.5kJmol-1,故答案为:631.5;
(2)CH3COOH为酸,pH=-lgc(H+),pH等于5的CH3COOH溶液中C(H+)=1.0×10-5mol/L,25℃时:Kw=c(OH-)×c(H+)=10-14,溶液中的c(OH-)=![]() =1.0×10-9mol/L,pH等于5的CH3COOH溶液中氢离子来源为乙酸的电离和水的电离,但乙酸溶液中水电离出的氢离子浓度等于氢氧根离子浓度,所以由水电离出的C(H+)是1.0×10-9mol/L,往溶液中加入少量NaOH固体,反应生成醋酸钠,溶液中
=1.0×10-9mol/L,pH等于5的CH3COOH溶液中氢离子来源为乙酸的电离和水的电离,但乙酸溶液中水电离出的氢离子浓度等于氢氧根离子浓度,所以由水电离出的C(H+)是1.0×10-9mol/L,往溶液中加入少量NaOH固体,反应生成醋酸钠,溶液中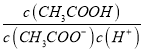 =
=![]() 温度不变电离平衡常数不变,故答案为:1.0×10-9mol/L;不变;
温度不变电离平衡常数不变,故答案为:1.0×10-9mol/L;不变;
(3)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水。
①由反应及图象可知,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存,故答案为:不能;
②由图象可知,pH=7时,c(OH-)=c(H+),溶液中含碳元素的主要微粒为HCO3-、H2CO3(少量),电荷守恒可知c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-),则c(Na+)>c(Cl-),因HCO3-水解,则c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)=c(H+),故答案为:HCO3-;c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)=c(H+);
③CO32-的水解常数Kh=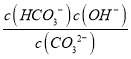 ,当溶液中c(HCO3-):c(CO32-)=1:1时,图象可知pH=10,c(H+)=10-10mol/L,由Kw可知c(OH-)=10-4mol/L,则Kh=
,当溶液中c(HCO3-):c(CO32-)=1:1时,图象可知pH=10,c(H+)=10-10mol/L,由Kw可知c(OH-)=10-4mol/L,则Kh=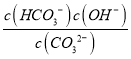 =c(OH-)=10-4mol/L,故答案为:10-4。
=c(OH-)=10-4mol/L,故答案为:10-4。


科目:高中化学 来源: 题型:
【题目】氨在国防、工农业等领域发挥着重要作用。工业以甲烷为原料生产氨气的过程如下:![]()
(1)过程Ⅰ中,有关化学反应的能量变化如下图所示

反应①为___________(“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2 (g)的热化学方程式是________________。
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ )溶液吸收,其反应原理为:[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)![]() [Cu(NH3)3]CH3COOCO(1),
[Cu(NH3)3]CH3COOCO(1), ![]()
①N元素在周期表中的位置为__________,NH3的电子式为__________。
②所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是__________(选填字母)。
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
(3)合成NH3的反应为放热反应,如果该反应平衡时,只改变一个条件,再次达到新平衡时,平衡常数K值变大。关于该反应的说法正确的是__________(填字母序号)。
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大再减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小再增大
(4)400℃,28MPa时,将1molN2和3mol H2混合充入体积可变的密闭容器中,加入催化剂,10分钟后反应达到平衡时N2转化率为60%。该温度下的平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

(5)一种直接供氨式固体氧化物燃料电池能量转化率达85%,其结构示意图如图所示:
①负极的电极反应式是_____________。
②用该电池电解300mL的饱和食盐水。一段时间后,溶液pH=13(忽略溶液体积的变化),则消耗NH3溶液的体积是_____L。(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属及其化合物的说法中正确的是
A. 氧化钠和过氧化钠都属于碱性氧化物
B. 豆粒大的金属钠投入到硫酸铜溶液中,析出红色的固体物质
C. 金属钠、镁着火时,可用“干冰”进行灭火
D. 运用铝热反应原理可以冶炼金属铬、锰等难熔金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一带一路”构建人类命运共同体,符合国际社会的根本利益,彰显人类社会共同理想和美好追求。下列贸易的商品中,主要成分属于蛋白质的是( )
A.捷克水晶B.埃及长绒棉C.乌克兰葵花籽油D.中国丝绸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
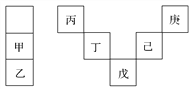
A. 丙与戊的原子序数相差25
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质均能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为 , K+移向 极(填A、B)

(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:①A电极附近可观察到的现象是 。
②B电极上的电极反应式为 ,总反应化学方程式是 。
③反应一段时间后打开K2 , 若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL, 将溶液充分混合,溶液的pH约为 。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 。
(3)如要用电解方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 ,电极反应式是 ,反应一段时间后电解质溶液中Cu2+浓度 (填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 常温下,5.6g Fe与含0.2mol HNO3的溶液充分作用,最少会失去电子数为0.15NA
B. 3g![]() 所含的电子数为1.8NA
所含的电子数为1.8NA
C. 常温下,1L 0.1mol/L AlCl3溶液中阳离子数目小于0.1NA
D. 15.6g Na2O2 和Na2S的固体混合物中,含有阴离子数目为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com