
【题目】某有机物的结构简式为CH2=CH— CH2OH。下列关于该有机物的叙述不正确的是
A.能与金属钠发生反应并放出氢气
B.能在催化剂作用下与H2发生加成反应
C.在浓H2SO4催化下能与乙酸发生酯化反应
D.能发生银境反应
科目:高中化学 来源: 题型:
【题目】亚硝酸为弱酸,其钠盐(亚硝酸钠NaNO2)外观酷似食盐且有咸味,过量使用会使人中毒。其银盐不溶于水。某化学兴趣小组对亚硝酸钠的制备进行了探究。
(1)请设计一种简单方法鉴别NaCl和NaNO2 :___________。
(2)利用如图完成一氧化氮与过氧化钠反应制备业硝酸钠。查阅资料:2NO + Na2O2 =2NaNO2, 2NO2+ Na2O2=2NaNO3, NO 能被酸性高锰酸钾氧化为NO3-。回答下列问题:

① 检查装置气密性后,应进行的操作是_________。
② 装置B 中Cu 参与反应的离子方程式为______,装置C 的作用是______。
③ 装置E发生反应的离子方程式为________。
④ 同学们经过讨论认为上述装置仍然存在缺陷,D中生成的产物不纯,D管中可能含有的杂质为________(填化学式),你认为应该进行的改进是__________。
(3)测定制取样品中NaNO2的纯度。
步骤:a.在5个有编号的带刻度的试管中分别加入不同体积、相同浓度的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL,并振荡,制成标准色阶;
试管编号 | ① | ② | ③ | ④ | ⑤ |
NaNO2含量(mg/L) | 0 | 20 | 40 | 60 | 80 |
b.称量0.10g制得的样品,溶于水配成500mL溶液。取5mL待测液,加入1mLM,再加入蒸馏水至l0mL,并振荡,与标准色阶比较。
比较结果:待测液与④标准色阶相同,则制取样品中NaNO2的纯度是________。
查阅资料可知:维生素C可有效降低NaNO2的含量。请完成下列实验验证方案:取5 mL 待测液,加入______,振荡,再加入1mL M溶液,_____,再振荡,与④ 标准色阶对比。实验现象为紫红色比④ 标准色阶浅,则证明维生素C可以有效降低NaNO2的含量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属与水的反应说法正确的是
A. 钠可以沉入水底与水剧烈反应
B. 由于铝锅可以用于烧水,因此铝不能跟沸水反应
C. 铁和冷水可以反应生成四氧化三铁和氢气
D. 金属的活泼性越弱,与水反应时需要的条件越苛刻
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某澄清透明的酸性溶液中,能共存的离子组是
A.NH4+、Cl-、Fe3+、K+ B.Na+、SO32-、K+、Cl-
C.MnO4-、Fe2+、Na+、SO42- D.K+、SO42-、HCO3-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组分子中的各个原子,或者处于同一平面,或者在一条直线上的是( )
A.CO2,HCl,HC≡CCH3
B.C6H6,C2H4,CO2
C.C6H6,HCl,CH4
D.C2H6,HCl,C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法处理酸性污水的工作原理如图。下列说法正确的是
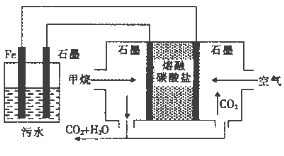
A. 左侧装置中的铁电极可换成石墨电极
B. 通入甲烷的石墨电极的电极反应式为: CH4+4CO32——8e—=5CO2+2H2O
C. 通入空气的石墨电极做正极,发生氧化反应
D. 若左侧装置中石墨电极产生标况下气体44.8L气体, 则消耗2mol甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、Cl﹣、OH﹣、CO32﹣、NO3﹣.向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有( )
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ氢、碳、氮都是重要的非金属元素,它们的单质及其化合物在科学研究和工业生产中有重要的应用。
(1)下列微粒基态的电子排布中未成对电子数最多的是__(填序号)
a.N3- b.Fe3+ c.Cu d.Cr e.C
(2)第一电离能介于B、N之间的第二周期元素有_____种。
(3)已知HCO3-在水溶液中可通过氢键成为二聚体(八元环结构),试画出该二聚体的结构式:____________________________。
(4)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O![]() [Zn(H2O)4]2++4HOCH2CN
[Zn(H2O)4]2++4HOCH2CN
①Zn2+基态核外电子排布式为____。1 mol HCHO分子中含有σ键的物质的量为____mol。
②HOCH2CN分子中碳原子轨道的杂化类型是__。与H2O分子互为等电子体的阴离子为__。
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为______。
Ⅱ.由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14∶4∶5∶1∶1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6ns1,回答下列问题。
(1)该配位化合物X的化学式为________。
(2)元素B、C、D的第一电离能由小到大排列顺序为________。(用元素符号表示)
(3)D元素原子的最外层电子轨道表示式为________。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可任意比互溶,解释其主要原因为_______________________。
(5)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1∶1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com