
【题目】下列元素中,占细胞干重最多的化学元素是( )
A. 氮 B. 氢 C. 氧 D. 碳
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】乙醇分子中不同的化学键如图所示:关于乙醇在各种不同反应中断键的说法不正确的是 ( )
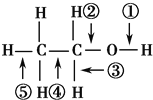
A. 和金属钠反应键①断裂
B. 在Ag催化下和O2反应键①④断裂
C. 和浓硫酸共热140℃时,键①或键②断裂,170℃时键②⑤断裂
D. 和氢溴酸反应键①断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. 酸性高锰酸钾溶液与稀草酸反应:5C2O42-+2MnO4-+16H+===2Mn2++10CO2+8H2O
C. AgCl的悬浊液中滴加Na2S溶液:2AgCl+S2-===Ag2S+2Cl-
D. NH4HCO3溶液加入过量NaOH溶液加热:NH4++OH-===NH3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组设计实验探究SO2的性质。
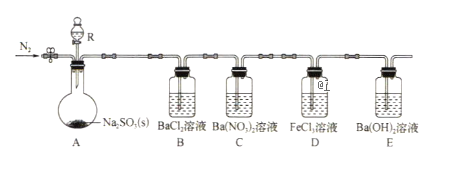
实验现象:B中无沉淀生成,C中有白色沉淀,D中溶液颜色变浅,E中产生白色沉淀.
(1)仪器R的名称是__________.
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式:__________.
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应。“通入一段时间的N2"的目的是____.
(4)探究装置C中通人SO2的量与产物的关系。
①他们提出如下猜想:
猜想1:通人过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O=BaSO4+2SO42-+2NO+4H+
猜想2:通入少量的SO2,则发生反应的离子方程式为__________。
②请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
实验步骤 | 实验现象及结论 |
取少量C中反应后溶液于试管中, __________ | __________ |
(5)下列可检验装置D反应后溶液中是否有Fe2+的最佳试剂是(填字母)(_____)
A.KSCN溶液 B.NaOH溶液 C.K3[Fe(CN)6]溶液 D.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适量M于试管中,滴少量盐酸(M剩余),所得溶液的pH__________7(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A.H+、Na+、HCO3-、NO3-B.Ag+、NO3-、Cl-、Na+
C.Na+、Mg2+、SO42-、Cl-D.Na+、H+、OH-、ClO—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表回答下列问题:
(1)写出元素Cu的基态原子的电子排布式:____________________。
(2)某元素A的核外价电子排布式为nsnnpn+1,该元素A原子核外最外层电子中成对电子共有________对。此元素A原子与O的第一电离能的相对大小为:A________ O(填“<”“>”或“=”)。
(3)元素C形成的最高价氧化物中含有________个π键。C和Cl形成化合物的电子式为_____________,此化合物中C的杂化方式为________。
(4)已知元素钒形成单质的晶胞如下图所示,则其原子的配位数是________,假设晶胞的边长为d cm、密度为ρ g·cm-3,则元素钒的相对原子质量为_____________ (NA为阿伏加德罗常数)。
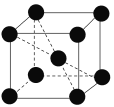
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是( )
A.Na+、Ba2 +、Cl-、SO42-B.K+、AlO2-、NO3-、OH-
C.H+、NH4+、Al3+、SO42-D.H+、Cl-、CH3COO-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于原电池的叙述中正确的是( )
A.构成原电池的两极必须是两种不同金属
B.原电池是将化学能转化为电能的装置
C.原电池工作时总是负极溶解,正极上有物质析出
D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com