
【题目】下列事实不能用勒夏特列原理解释的是
A.氯水中存在反应![]() ,当加入CaCO3固体后,溶液颜色变浅
,当加入CaCO3固体后,溶液颜色变浅
B.分别用等体积的蒸馏水和0.010mol·L-1硫酸洗涤BaSO4沉淀,后者损失的BaSO4沉淀较少
C.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
D.合成氨工业中新发明的钌基催化剂的催化作用优于传统的铁催化剂
【答案】D
【解析】
A.氯水中存在反应Cl2+H2O![]() H++Cl-+HClO,当加入CaCO3固体后,消耗溶液中的H+,平衡正向移动,Cl2的浓度减小,颜色变浅,能用勒夏特列原理解释,A不符合题意;
H++Cl-+HClO,当加入CaCO3固体后,消耗溶液中的H+,平衡正向移动,Cl2的浓度减小,颜色变浅,能用勒夏特列原理解释,A不符合题意;
B.BaSO4(s) ![]() Ba2+(aq)+SO42-(aq),用0.010mol·L-1硫酸洗涤BaSO4沉淀,溶液中的硫酸根离子,对硫酸钡的溶解起到抑制作用,能用勒夏特列原理解释,B不符合题意;
Ba2+(aq)+SO42-(aq),用0.010mol·L-1硫酸洗涤BaSO4沉淀,溶液中的硫酸根离子,对硫酸钡的溶解起到抑制作用,能用勒夏特列原理解释,B不符合题意;
C.2SO2+O2![]() 2SO3 ,增大氧气的浓度,提高二氧化硫的转化率,能用勒夏特列原理解释,C不符合题意;
2SO3 ,增大氧气的浓度,提高二氧化硫的转化率,能用勒夏特列原理解释,C不符合题意;
D.催化剂能同等倍数的改变正逆反应速率,不影响反应物的平衡转化率,不能用勒夏特列原理解释,D符合题意;
答案选D。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】工业上苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,如图是苯乙烯的结构简式:![]() ,下列关于该有机物的说法不正确的是( )
,下列关于该有机物的说法不正确的是( )
A. 苯乙烯的分子式为C8H8
B. 苯乙烯通过加聚反应可制备高分子化合物
C. 苯乙烯与溴的四氯化碳溶液反应:![]()
D. 苯乙烯能发生加成反应,但不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F都是有机化合物,它们的转化关系如下:
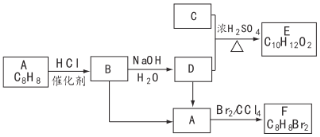
请回答下列问题:
(1)化合物C中含有官能团的名称为________,A为一取代芳香烃,共面的碳原子最多有________个。
(2)D中含有一个甲基,由B生成D的化学方程式为________。
(3)由A生成B的反应类型为________。
(4)由B生成A的反应条件是________。
(5)E存在于栀子香油中,其结构简式为________。
(5)在F的同分异构体中,苯环上一硝化产物只有一种,核磁共振有两组峰且峰面积比为![]() 的是________(填结构简式)。
的是________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工原料。接触法生产的硫酸产品有98%的硫酸、20%的发烟硫酸(H2SO4和SO3的混合物,其中SO3的质量分数为0.2)。
完成下列计算:
(1)若不计生产过程的损耗,__________m3 SO2(折合成标准状况)经充分转化、吸收,可产出1吨 98%的硫酸(密度为1.84g/mL)。若98%的硫酸可表示为SO3![]() H2O,20%的发烟硫酸可表示为SO3aH2O,则a的值为 ___________(用分数表示)。
H2O,20%的发烟硫酸可表示为SO3aH2O,则a的值为 ___________(用分数表示)。
(2)铝和铝的化合物在社会生产和人类生活中也有着重要的作用。现有甲、乙两瓶无色溶液,已知它们可能是Na[Al(OH)4]溶液和H2SO4溶液。现经实验获得如下数据:
(已知:2Na[Al(OH)4]+H2SO4→2Al(OH)3↓+Na2SO4+2H2O)
组别 | 甲(mL) | 乙(mL) | 沉淀的物质的量(mol) |
① | 140 | 10 | 0.02 |
② | 10 | 140 | 0.02 |
③ | 20 | 560 | 0.04 |
请通过必要的计算推断过程回答:乙溶液中的溶质是什么________?其物质的量浓度为多少________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在银球和铁球之间用铂丝连接,用一根绝缘的细丝悬挂,使之平衡(如图),然后小心地从烧杯中央滴入CuSO4溶液。下列说法正确的是
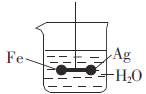
A.铁球降低,银球升高
B.铁球升高,银球降低
C.铁球表面出现红色物质
D.银球表面无任何现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)工业合成氨的原理为N2(g)+3H2(g)2NH3(g) H=-92.4kJ·mol-1。现将6molN2和14molH2充入如图所示密闭容器中,保持压强不变,开始时活塞的位置如图1所示,当反应达到平衡时,活塞的位置如图2所示。

①下列表述能说明反应已达到平衡的是___(填字母)。
A.活塞不再移动
B.容器内压强不再改变
C.容器内气体密度不再改变
D.容器内气体的平均相对分子质量不再改变
②已知某次反应过程中逆反应速率随时间的变化关系如图所示,在t1时刻改变了某一条件,则改变的一种条件是_____。

(2)治理NO的一种方法是先将NO氧化成NO2后,再将NO2通入还原性碱溶液中电解转化成N2,其中氧化的反应原理为NO(g)+O3(g)NO2(g)+O2(g) H<0。下列说法正确的是____(填字母)。
A.已知该反应在较低温度下能自发进行,说明S=0
B.加入催化剂,可降低反应的活化能和焓变,从而加快反应的速率
C.活化分子有效碰撞理论中,活化能指活化分子平均能量与非活化分子平均能量的差值
D.在一定温度下,向恒容密闭容器中充入物质的量之比为1:3的NO和O3,达到平衡时NO转化率为a,再充入一定量物质的量之比为1:3的NO和O,NO转化率不变。
(3)处理汽车尾气中的氮氧化物还可以用NH3还原法,假设在恒容密闭容器中,仅发生反应:![]() △H<0。测得NO的平衡转化率随温度的变化关系如图所示,已知温度为T3时,反应达到平衡所需时间为10min。请在图中画出不同温度下(其他条件均相同),反应都经过10min时,NO转化率的曲线示意图_____________。
△H<0。测得NO的平衡转化率随温度的变化关系如图所示,已知温度为T3时,反应达到平衡所需时间为10min。请在图中画出不同温度下(其他条件均相同),反应都经过10min时,NO转化率的曲线示意图_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 冰镇的啤酒打开后泛起泡沫
B. 对N2+3H2![]() 2NH3的反应,使用铁触媒可加快合成氨反应的速率
2NH3的反应,使用铁触媒可加快合成氨反应的速率
C. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
D. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是短周期的一部分,若c原子的最外层上有5个电子,则下列说法中错误的是
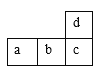
A.a单质可跟d的最高价氧化物对应的水化物反应
B.原子半径a>b>c﹥d
C.b的氢化物比c的氢化物不稳定
D.a的最高价氧化物的水化物比b的最高价氧化物的水化物酸性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com