
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϡ��Ӵ��������������Ʒ��98�������ᡢ20���ķ������ᣨH2SO4��SO3�Ļ�������SO3����������Ϊ0.2����
������м��㣺
��1���������������̵���ģ�__________m3 SO2���ۺϳɱ�״���������ת�������գ��ɲ���1�� 98%�����ᣨ�ܶ�Ϊ1.84g/mL������98��������ɱ�ʾΪSO3![]() H2O��20���ķ�������ɱ�ʾΪSO3aH2O����a��ֵΪ ___________���÷�����ʾ����
H2O��20���ķ�������ɱ�ʾΪSO3aH2O����a��ֵΪ ___________���÷�����ʾ����
��2���������Ļ��������������������������Ҳ������Ҫ�����á����мס�����ƿ��ɫ��Һ����֪���ǿ�����Na[Al��OH��4]��Һ��H2SO4��Һ���־�ʵ�����������ݣ�
����֪��2Na[Al��OH��4]+H2SO4��2Al��OH��3��+Na2SO4+2H2O��
��� | �ף�mL�� | �ң�mL�� | ���������ʵ�����mol�� |
�� | 140 | 10 | 0.02 |
�� | 10 | 140 | 0.02 |
�� | 20 | 560 | 0.04 |
��ͨ����Ҫ�ļ����ƶϹ��̻ش�����Һ�е�������ʲô________�������ʵ���Ũ��Ϊ����________��
���𰸡�224 ![]() ��ΪNa[Al��OH��4]��Һ Ũ��Ϊ��8.5 mol��L-1
��ΪNa[Al��OH��4]��Һ Ũ��Ϊ��8.5 mol��L-1
��������
��1������SO2��SO3��H2SO4��֪��Ҫ������������Ϊ![]() =2.24��105L=224m3��20%�ķ���H2SO4��ʾΪSO3aH2O����Ϊ��aH2SO4����1-a��SO3����Ϊ20���ķ������ᣨH2SO4��SO3�Ļ�������SO3����������Ϊ0.2��������20%��������H2SO4��SO3��������ϵ�ɵã�98a��80(1-a)=(1-20%)��20%����ã�a=
=2.24��105L=224m3��20%�ķ���H2SO4��ʾΪSO3aH2O����Ϊ��aH2SO4����1-a��SO3����Ϊ20���ķ������ᣨH2SO4��SO3�Ļ�������SO3����������Ϊ0.2��������20%��������H2SO4��SO3��������ϵ�ɵã�98a��80(1-a)=(1-20%)��20%����ã�a=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��2��������ΪH2SO4������Al��OH��3���������ᣬ��ٵ��ڹ�����Na[Al��OH��4]���٣�H2SO4���ӵĹ����У����ɳ�����Ȼ���٣���ʵ��������ɳ���û�м��٣�˵�����������ΪNa[Al��OH��4]���ڵ��۵Ĺ�������������һ����Na[Al��OH��4]���Ӷ���һ�����������պö���һ����˵���ڢ���Na[Al��OH��4]������������ȫ��Ӧ�����ݢڽ�Ϸ���ʽ2Na[Al��OH��4]+H2SO4��2Al��OH��3��+Na2SO4+2H2O��֪10mL������Һ����������ʵ�����0.01mol���������������Ϊ0.01mol��14=0.14mol��H+�����ʵ���=0.28mol���ڢ��з����ķ�Ӧ��������4H++[Al��OH��4]-=Al3++4H2O��Al3++3[Al��OH��4]-=4Al��OH��3�����ɷ���ʽ��֪����Na[Al��OH��4]�����ʵ���= 0.07mol+0.15mol=0.085mol��������Ũ����![]() mol��L-1���ʴ�Ϊ����ΪNa[Al��OH��4]��Һ��Ũ��Ϊ��8.5 mol��L-1��
mol��L-1���ʴ�Ϊ����ΪNa[Al��OH��4]��Һ��Ũ��Ϊ��8.5 mol��L-1��


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ������Ҫ����500mL 0.10mol/L Na2CO3��Һ��

��1�����貣�������У����������ձ���100mL��Ͳ��________��________
��2��ʵ��ʱͼ����ʾ�������Ⱥ�˳��Ϊ________�����ţ�
��3�������ƹ����У����в�����������ҺŨ������Ӱ�죿������ƫ��������ƫ����������Ӱ������
�ٳ���ʱ����������������________ ��ת����Һ��û��ϴ���ձ��Ͳ�����________
��������ƿ��ˮ����ʱ����Һ��________ ��ҡ�Ⱥ�Һ���½����ټ�ˮ���̶���________
��4������Na2CO3���������Ϊ____g��������Ũ��Һϡ�ͣ���Ҫ��ȡ2mol/L Na2CO3��Һ________mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������¼����л��
��![]() ��
��![]() ��
�� ��
��![]() ��
��![]()
��![]() ��
��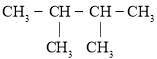 ��
��![]() ��
�� ![]()
�������������������ʰ�Ҫ��ش��������⣺
(1)�۵�ϵͳ������________��
(2)�á�������ʾ�٢ۢܢ��۷е�ߵ�˳��________������ţ���
(3)��ۻ�Ϊͬϵ�����________������ţ���
(4)���һ�ȴ���ͬ���칹����Ŀ��________�֡�
(5)��120�棬![]() �����£�ij����̬����������
�����£�ij����̬����������![]() ��ȫ��Ӧ��÷�Ӧǰ����������û�з����ı䣬�������________������ţ���
��ȫ��Ӧ��÷�Ӧǰ����������û�з����ı䣬�������________������ţ���
(6)д������������������������Һ�巢��ȡ����Ӧ�Ļ�ѧ����ʽ________��
(7)���ڼ��������º�CuO��Ӧ�Ļ�ѧ����ʽ________��
(8)�ں͢ݷ�����Ӧ�Ļ�ѧ����ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2���ǻ��춡������������ˮ����һ��Ӧ�����л��ϳɺ�ҩ������Ļ���ԭ�ϡ�

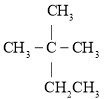
��1��2���ǻ��춡�������ķ���ʽΪ_________����ͬ��ѧ���������ں˴Ź�������ͼ���в�ͬ�����շ壬��2���ǻ��춡��������_________�����շ壻
��2���٢ڵķ�Ӧ���ͷֱ�Ϊ_________��_________��
��3����֪IΪ�������I��B�Ļ�ѧ����ʽΪ_________��
��4�����۲���F�Ľṹ��ʽΪ_________��
��5�������![]() ��
�� ��˵����ȷ����_________��˫ѡ������ĸ����
��˵����ȷ����_________��˫ѡ������ĸ����
A����������FeCl3��Һ����ɫ����ǰ�߲���
B�����߶�������NaHCO3��Һ��Ӧ�ų�CO2
C�����߶�����������������Һ������Ӧ�����������ʵ������ʱ�������������Ƶ��������
D�����߶����������������ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��̵������仯������ͼ��ʾ����

A. ����кͷ�Ӧ
B. CH4��O2��ȼ��
C. NH4Cl������Ba(OH)28H2O�����Ͻ���
D. CaO����ˮ����Ca(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
A.��ˮ�д��ڷ�Ӧ![]() ��������CaCO3�������Һ��ɫ��dz
��������CaCO3�������Һ��ɫ��dz
B.�ֱ��õ����������ˮ��0.010mol��L-1����ϴ��BaSO4������������ʧ��BaSO4��������
C.��ҵ����������Ĺ�����ʹ�ù����Ŀ�������߶��������������
D.�ϳɰ���ҵ���·������ɻ������Ĵ��������ڴ�ͳ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧ��ʴ���������о�װ����ͼ��ʾ�������й�˵������ȷ����

A.��a��b�õ���������ʯī�缫�������ݲ���
B.��a��b���õ���������c����d�����ײ�������
C.��a��b�õ�����������Ƭ��Ҫ����������ʴ
D.��a��b�ֱ����ӵ�Դ���������������ӿ���Ƭ�ĸ�ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1100��ʱ�������Ϊ5L���ܱ������У��������淴Ӧ��Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)���ﵽƽ�⣬��������и��⣺
Na2S(s)+4H2O(g)���ﵽƽ�⣬��������и��⣺
��1��������Ӧ���漰�ķǽ���Ԫ��ԭ�ӵİ뾶�Ӵ�С��˳��Ϊ_____________���ǽ�������ǿ��Ԫ��ԭ�ӵĵ����Ų�ʽ_________________������ӵ�����������________�֡�
��2���÷�Ӧ��O��S����ͬ����Ԫ�أ��Ƚ����ǵĵ��ʵ�������_____________________���û�ѧ����ʽ��ʾ����д��Na2O�ĵ���ʽ______���Ƚ�Na2O��Na2S���۵�ߵͣ�Na2O___Na2S��
��3������ƽ���ƽ�ⳣ������ʽK��______________________�������¶ȣ�Kֵ��С��������ӦΪ_______(��������������������)��Ӧ��
��4�����жϷ�Ӧ�ﵽƽ��״̬��������_____________(�����)��
A����������ѹǿ���� B�����������ܶȲ���
C����������ƽ����Է����������� D���������Ũ�����
��5������ʼʱ�����Na2SO4Ϊ2.84g��10���Ӻ�ﵽƽ��ʱNa2SO4��ת����Ϊ45%��V(H2)=__________________��ƽ����������г���1molH2��ƽ����_________________����������Ӧ�����������淴Ӧ�������������ƶ����������´ﵽƽ�����ԭƽ����ȣ�H2������ٷֺ���_____________(����������������С������������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
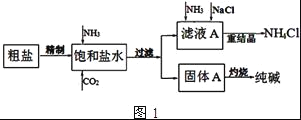
����Ŀ�����Na2CO3�������������о��й㷺����;����ͼ1��ʵ����ģ���Ƽ�ԭ����ȡNa2CO3������ͼ��
���������գ�
��֪�������к���Ca2+��Mg2+��SO42�����������ӣ�
��1�����Ƴ��ӵIJ���˳����____��___��____��____��____ ������ĸ��ţ���
a �����ܽ� b ���������pH c ����Ba��OH��2��Һ d ����Na2CO3��Һ e ����
��2����ʳ��ˮ����ͨ��NH3����ͨ��CO2��������______������Һa��ͨ��NH3�ͼ��뾫�ε�Ŀ����______��
��3������ͼ1����ͼ��������������ѭ����·�ߣ�____
��4��ͼ2װ���г�����ʵ�����Ʊ�CO2����__������ĸ��ţ�����cװ���Ʊ�NH3����ƿ�ڿɼ�����Լ���___�����Լ����ƣ���
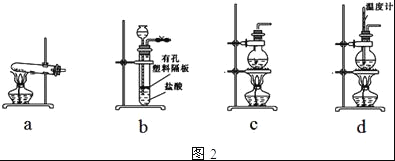
��5��һ����Ȼ���ɷ���aNa2CO3bNa2SO4cH2O�����������ṩ���Լ�����ƲⶨNa2CO3����������ʵ�鷽�������ʵ�鷽������������
��ѡ����Լ���ϡH2SO4��BaCl2��Һ��ϡ��ˮ����ʯ�ҡ�Ba��OH��2��Һ
��______��
��______��
��______��
�ܼ�����Ȼ����к�Na2CO3������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com