
【题目】电化学原理在防止金属腐蚀、能量转换、物质制备等方面应用广泛。
(1)钢闸门在海水中易被腐蚀,常用以下两种方法减少其腐蚀:
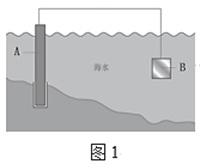
①图1中,A为钢闸门,材料B可以选择___(填字母序号)。
a.碳棒 b.铜板 c.锌板
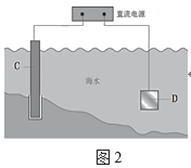
②图2中,钢闸门C做___极。用氯化钠溶液模拟海水进行实验,D为石墨块,则D电极反应式为___,检验该电极反应产物的方法___。
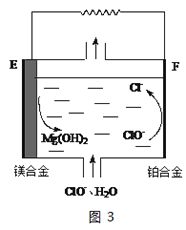
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的___极(填“正”或“负”)。F电极上的电极反应式为___。
(3)利用电化学法生产硫酸,可使绝大多数单质硫直接转化为SO3,在生产硫酸的同时还能化学发电。图4为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子。
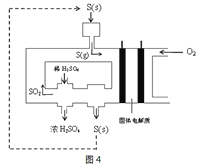
①正极每消耗4.48LO2(标准状况下),电路中转移电子的数目为___。
②S(g)在负极生成SO3的电极反应式为___。
【答案】c 阴 2Cl--2e-=Cl2↑ 将湿润的淀粉碘化钾试纸放在阳极附近,试纸变蓝,证明生成氯气 负 ClO- +2e-+H2O=Cl-+2OH- 0.8NA或4.816×1023 S-6e-+3O2-=SO3
【解析】
(1)①图1中,装置为原电池,A为钢闸门,要保护A,A应做正极,则材料B的金属性比A强。
②图2中,装置为电解池,要保护钢闸门C,C应不失电子。用氯化钠溶液模拟海水进行实验,D为石墨块,则D电极为阳极,溶液中的Cl-失电子生成Cl2,检验该电极反应产物应使用湿润的淀粉碘化钾试纸。
(2)E为镁合金,在该电极,镁失电子,F电极上ClO- 转化为Cl-。
(3)①正极O2+4e-=2O2-,由此可计算电路中转移电子的数目。
②在负极S(g)失电子转化为SO3。
(1)①图1中,装置为原电池,A为钢闸门,要保护A,A应做正极,则材料B应选择金属性比A强的锌。答案为:c;
②图2中,装置为电解池,要保护钢闸门C,C应做阴极。用氯化钠溶液模拟海水进行实验,D为石墨块,则D电极为阳极,电极反应式为2Cl--2e-=Cl2↑,检验该电极反应产物的方法为将湿润的淀粉碘化钾试纸放在阳极附近,试纸变蓝,证明生成氯气。答案为:阴;2Cl--2e-=Cl2↑;将湿润的淀粉碘化钾试纸放在阳极附近,试纸变蓝,证明生成氯气;
(2)E为镁合金,做该燃料电池的负极。F电极为正极,电极反应式为ClO- +2e-+H2O=Cl-+2OH-。答案为:负;ClO- +2e-+H2O=Cl-+2OH-;
(3)①正极O2+4e-=2O2-,n(O2)=![]() =0.2mol,则电路中转移电子的数目为0.2mol×4NA= 0.8NA或4.816×1023。答案为:0.8NA或4.816×1023;
=0.2mol,则电路中转移电子的数目为0.2mol×4NA= 0.8NA或4.816×1023。答案为:0.8NA或4.816×1023;
②在负极S(g)在O2-存在的环境中失电子,转化为SO3,电极反应式为S-6e-+3O2-=SO3。答案为:S-6e-+3O2-=SO3。


科目:高中化学 来源: 题型:
【题目】实验室药品必须按规定存放,下列对错误存放后出现现象的解释合理的是( )
A.石灰水敞口存放,出现白色固体:![]()
B.浓硝酸存放于无色细口瓶中,颜色变黄:![]()
C.酸化的硫酸亚铁溶液长时间存放,溶液变黄:![]()
D.将氨水和浓盐酸存放在同一个药品柜中,柜壁出现白色固体:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g)![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列叙述正确的是
①增加A的量,平衡向逆反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) ΔH1
O2(g)=H2O(g) ΔH1
![]() N2(g)+O2(g)=NO2(g) ΔH2
N2(g)+O2(g)=NO2(g) ΔH2
![]() N2(g)+3/2H2(g)=NH3(g) ΔH3
N2(g)+3/2H2(g)=NH3(g) ΔH3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
A. 2ΔH1+2ΔH2-2ΔH3B. ΔH1+ΔH2-ΔH3
C. 3ΔH1+2ΔH2+2ΔH3D. 3ΔH1+2ΔH2-2ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
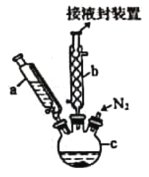
【题目】二茂铁[Fe(C5H5)2,结构简式为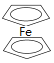 ,广泛应用于航天、化工等领域中。实验室制备二茂铁的装置如图所示。
,广泛应用于航天、化工等领域中。实验室制备二茂铁的装置如图所示。
已知:①二茂铁熔点是173 ℃,在100 ℃时开始由固体直接变为气体;沸点是249 ℃。
②制备二茂铁的反应原理为2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O。
实验步骤为:
①在三颈烧瓶中加入16.8 g粉末状的KOH,并从仪器a中加入60 mL无水乙醚到烧瓶中,充分搅拌,同时通氮气5 min左右;
②再从仪器a滴入13.9 mL新蒸馏的环戊二烯(C5H6,密度为0.95 g/cm3),搅拌;
③将25.4 g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25 mL装入仪器a中,慢慢滴入仪器c中,45 min滴完,继续搅拌45 min;
④再从仪器a加入25 mL无水乙醚,搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得到橙黄色溶液;
⑥蒸发橙黄色溶液,得到二茂铁粗产品;
⑦二茂铁粗产品的提纯。
回答下列问题:
(1)仪器b的名称是________________。
(2)步骤①中通入氮气的目的是________________。
(3)仪器c的适宜容积应为________________(填标号)。
A. 100 mL B. 250 mL C. 500 mL D. 1000 mL
(4)步骤⑤用盐酸洗涤的目的是________________.
(5)步骤⑦的实验装置如图所示,二茂铁在扎有小孔的滤纸上凝结,该分离提纯方法的名称是________________,装置中棉花的作用是________________。
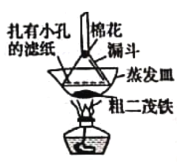
(6)为了确认得到的是二茂铁,还需要进行的一项简单实验是________________。
(7)若最终制得纯净的二茂铁11.16 g,则该实验的产率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是( )
A. 浓度均为0.1 mol·L-1的氨水和盐酸等体积混合后:c(H+)=c(OH-)+c(NH3·H2O)
B. 等浓度的碳酸钠、碳酸氢钠溶液混合后:c(CO![]() )<c(HCO
)<c(HCO![]() )
)
C. 在NaHB溶液中一定有:c(Na+)=c(HB-)+2c(B2-)
D. Na2CO3溶液中:2c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y、Z、W是五种短周期主族元素,原子序数依次增大,其中X、Y、Z同周期,R、W与X、Y、Z不在同一周期,它们可组成某种离子化合物的结构如图所示。下列说法不正确的是( )
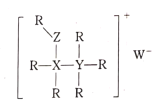
A.原子半径:X>Y>Z>R
B.氢化物的沸点:Z>Y>X
C.X、Y、Z、R可形成多种既能与盐酸反应,又能与NaOH反应的化合物
D.管道工人可用YR3检验输送W2的管道是否泄露
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下物质:①石墨;②氯化氢气体;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;⑦氯化铁溶液;⑧纯醋酸;⑨氧化钠固体;⑩铝。
(1)属于非电解质的是______________;属于强电解质的是__________;属于弱电解质的是___________。(用序号填空)
(2)写出物质⑥溶于水溶液显碱性的原因_______(用离子方程式和简要文字说明作答)
(3)写出物质⑥和⑧在水中反应的离子方程式:_____________。
(4)配制溶液⑦时通常将⑦先溶于___________,然后再加水稀释,通过增加溶液中_______的浓度以防止其发生水解。
(5)浓度、体积相同的②和⑧的溶液,加入相同形状且足量的Zn粒,反应速率快的是___(用序号填空);pH值、体积相同的②和⑧的溶液时,产生气体的量多的是________。(用序号填空)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是一种高效的抗疟药,某研究性学习小组的同学通过查阅资料获得如下信息:青蒿素是由碳、氢、氧三种元素所组成的,熔点为156~157℃,他们设计了如下装置来测量青蒿素的分子组成,回答下列问题:
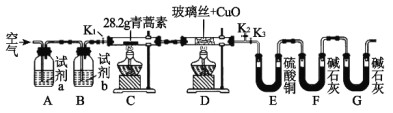
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
(1)试剂加入后首先要进行的操作是_____________,其目的是____________,实验中需要对开关K1、K2、K3进行操作,首次对开关K1、K2、K3进行操作的方法是________,适当时间后再关闭相应的开关,为提高实验的准确性,在C处停止加热后还应进行的操作是____________。
(2)试剂a、b分别是________________________________________,点燃C、D处酒精灯的先后顺序是___________________________,使用装置D的目的是___________。
(3)E中使用硫酸铜相对于使用CaCl2的好处(不考虑吸收效果的差异性)是_____。
(4)充分反应后获得的有关数据如上表(假设生成的气体全部被吸收):则测得青蒿素的最简式是_________________________。
(5)若要求出青蒿素的分子式,还需要通过实验测量出一个数据,请你指出该数据是什么,测量出该数据的方法是(只考虑理论上的可能性):___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com