
����Ŀ����ï��[Fe(C5H5)2���ṹ��ʽΪ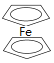 ���㷺Ӧ���ں��졢�����������С�ʵ�����Ʊ���ï����װ����ͼ��ʾ��
���㷺Ӧ���ں��졢�����������С�ʵ�����Ʊ���ï����װ����ͼ��ʾ��
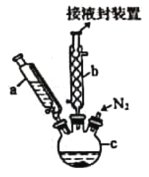
��֪���ٶ�ï���۵���173 �棬��100 ��ʱ��ʼ�ɹ���ֱ�ӱ�Ϊ���壻�е���249 �档
���Ʊ���ï���ķ�Ӧԭ��Ϊ2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O��
ʵ�鲽��Ϊ��
����������ƿ�м���16.8 g��ĩ״��KOH����������a�м���60 mL��ˮ���ѵ���ƿ�У���ֽ��裬ͬʱͨ����5 min���ң�
���ٴ�����a����13.9 mL������Ļ����ϩ(C5H6���ܶ�Ϊ0.95 g/cm3)�����裻
�۽�25.4 g��ˮFeCl2��(CH3)2SO(�������������ܼ�)��ɵ���Һ25 mLװ������a�У�������������c�У�45 min���꣬��������45 min��
���ٴ�����a����25 mL��ˮ���ѣ����裻
�ݽ�c�е�Һ��ת���Һ©���У����������ᡢˮ��ϴ�����Σ���Һ�õ��Ȼ�ɫ��Һ��
�������Ȼ�ɫ��Һ���õ���ï���ֲ�Ʒ��
�߶�ï���ֲ�Ʒ���ᴿ��
�ش��������⣺
(1)����b��������________________��
(2)�������ͨ�뵪����Ŀ����________________��
(3)����c�������ݻ�ӦΪ________________(����)��
A. 100 mL B. 250 mL C. 500 mL D. 1000 mL
(4)�����������ϴ�ӵ�Ŀ����________________.
(5)����ߵ�ʵ��װ����ͼ��ʾ����ï��������С����ֽ�����ᣬ�÷����ᴿ������������________________��װ��������������________________��
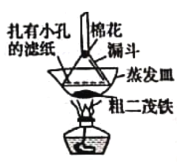
(6)Ϊ��ȷ�ϵõ����Ƕ�ï��������Ҫ���е�һ���ʵ����________________��
(7)�������Ƶô����Ķ�ï��11.16 g�����ʵ��IJ���Ϊ________________��
���𰸡����������ܻ������� �ž�װ���еĿ�������ֹFe2+������ B ��ȥ�����KOH ���� ��ֹ��ï���ӷ���������� �ⶨ���ù�����۵� 60%
��������
(1)���������Ľṹȷ������b�����ƣ�
(2)��ï��������+2�ۣ��ױ�����������������ͨ�뵪�����ž�װ���п�����
(3)����cΪ������ƿ������ʢ��Һ�������������ݻ���![]() �����жϣ�
�����жϣ�
(4)KOH��FeCl2��C5H6��Ӧ���ɶ�ï������Ӧ�������к��й����
(5)��ï���������������������ʣ������й���ֱ�ӱ�����壻���ɷ�ֹ��ï���ӷ����������
(6)���������Ǵ�����ʱ�й̶��۷е��жϣ�
(7)�ȼ���13.9 mL�����ϩ��25.4 g��ˮFeCl2�����ʵ��������ݶ��߷�Ӧ��ϵ�ж��������ʹ������Բ�����������Ϊ�������ï�������۲���������ʵ�ʲ��������۲����ıȿɵ�����ʡ�
(1)���������ṹʾ��ͼ��֪������b�����������ܣ�
(2)��ï������Ԫ�ػ��ϼ���+2�ۣ����ȶ�����ǿ�Ļ�ԭ�ԣ��ױ�����������������ͨ�뵪���ž�װ���п�������ֹʵ��������������ӱ�������
(3)��Ӧ��������ƿ�н��У��������֪������ƿ�й�����Һ��60 mL+25 mL=25 mL=110 mL��������ƿ��ʢ��Һ���������ܳ������ݻ���![]() ������Ҫѡ��ʹ��������ƿ�Ĺ����250 mL������ѡ����B��
������Ҫѡ��ʹ��������ƿ�Ĺ����250 mL������ѡ����B��
(4)KOH��FeCl2��C5H6��Ӧ���ɶ�ï��[Fe(C5H5)2]��KCl����ѧ����ʽΪ��2KOH+FeCl2+2C5H6�T[Fe(C5H5)2]+2KCl+2H2O����Ӧ����Һ���й���KOH���������������ϴ�ӵ�Ŀ���dz�ȥ�����KOH��
(5)��ï�������ɹ���ֱ�ӱ�����壬��������������Ȼ�����������ռ������������Ϊ��������©���ڲ��������ɷ�ֹ��ï���ӷ���������У�
(6)���ڴ������й̶����۷е㣬�������û�й̶����۷е㣬���Ҫȷ�ϵõ����Ƕ�ï��������Ҫ���е�һ���ʵ���Dzⶨ���ù������ʵ��۵㣻
(7)13.9 mL�����ϩ(C5H6���ܶ�Ϊ0.95 g/cm3)�����ʵ�����n(C5H6)=![]() =0.2 mol��25.4 g��ˮFeCl2�����ʵ���n(FeCl2)=
=0.2 mol��25.4 g��ˮFeCl2�����ʵ���n(FeCl2)=![]() =0.2 mol������2KOH+FeCl2+2C5H6�T[Fe(C5H5)2]+2KCl+2H2O��֪����Ӧ��ȡ��ï��ʱn(FeCl2)��n(C5H6)=1��2������FeCl2������Ҫ���ݲ������Ļ����ϩ�������ï�������۲�����n(��ï��)=
=0.2 mol������2KOH+FeCl2+2C5H6�T[Fe(C5H5)2]+2KCl+2H2O��֪����Ӧ��ȡ��ï��ʱn(FeCl2)��n(C5H6)=1��2������FeCl2������Ҫ���ݲ������Ļ����ϩ�������ï�������۲�����n(��ï��)=![]() n(C5H6)=0.1 mol���������϶�ï���IJ���m(��ï��)=0.1 mol��186 g/mol=18.6 g���ʲ���=
n(C5H6)=0.1 mol���������϶�ï���IJ���m(��ï��)=0.1 mol��186 g/mol=18.6 g���ʲ���=![]() ��100%=60%��
��100%=60%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�����ʵ���Ũ�ȵ���Һ�������ؼ�ʵ�鲽��Ͳ�����ͼ��

(1)����Ҫ94 mL 0.10 mol��L��1 Na2CO3��Һ�������ֳ����ơ�����ʵ�鲽��A~F��ȷ��ʵ�����Ϊ_______________________(����ĸ)������E�н�һ�����������µߵ����Σ�д��������������_________________��
(2)����Cͨ����Ϊ�ܽ⣬����Aͨ����Ϊ_________��
(3)��Na2CO3��10H2O�����Ƹ���Һ��������ƽ��ȡ��Ʒ��������Ҫ����ͼʾ________(��a��b)λ�ã�������ǰ�����Ѿ���һ����ʧȥ�˽ᾧˮ���������Ƶ���ҺŨ��ƫ_______(������������С��������Ӱ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ĸ�ͼ�У���ʾ2A��g����B��g��![]() 2C��g��������Ӧ���ȣ���������淴Ӧ����ȷͼ��Ϊ
2C��g��������Ӧ���ȣ���������淴Ӧ����ȷͼ��Ϊ
A.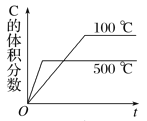 B.
B.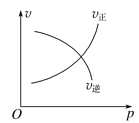
C.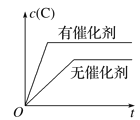 D.
D.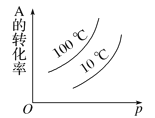
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ���ܽ���ˮ�е��Ҷ�����H2NCH2CH2NH2�������ɻ����Ѻõ����ʣ�ʾ��ͼ��ͼ��ʾ��a��b��Ϊʯī�缫������˵���������
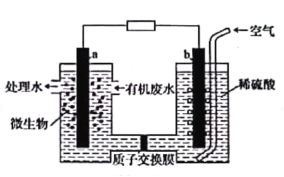
A.a�缫�ĵ缫��ӦΪH2NCH2CH2NH2-16e-+4H2O=2CO2��+N2��+16H+
B.��ع���ʱ����ͨ������Ĥ�ɸ��������������ƶ�
C.a�缫�ϵĵ��Ʊ�b�缫�ϵĵ��Ƶ�
D.��ع���ʱb�缫������Һ��pH���ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ������ȡ����������װ��ͼ������˵����ȷ���ǣ� ��
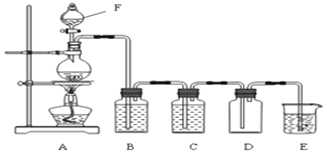
A.��Һ©����ʢװ����Ũ����
B.B��Ŀ����Ϊ�˳�ȥ�����е�ˮ��
C.E��Ŀ����Ϊ�˴���������������E��ʢװ����Ca(OH)2��Һ
D.D���ƿ���˿��������ռ������⣬������������ȫƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧԭ���ڷ�ֹ������ʴ������ת���������Ʊ��ȷ���Ӧ�ù㷺��
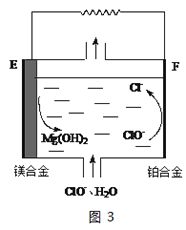
��1����բ���ں�ˮ���ױ���ʴ�������������ַ��������丯ʴ��
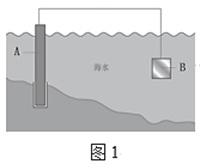
��ͼ1�У�AΪ��բ�ţ�����B����ѡ��___������ĸ��ţ���
a��̼�� b��ͭ�� c��п��
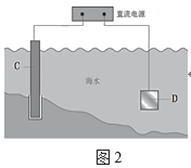
��ͼ2�У���բ��C��___�������Ȼ�����Һģ�⺣ˮ����ʵ�飬DΪʯī�飬��D�缫��ӦʽΪ___������õ缫��Ӧ����ķ���___��
��2��þȼ�ϵ���ڿ��ƶ������豸��Դ�ͱ��õ�Դ�ȷ���Ӧ��ǰ��������ͼ3Ϊ��þ������������ȼ�ϵ��ԭ��ʾ��ͼ���缫Ϊþ�Ͻ�Ͳ��Ͻ�EΪ��ȼ�ϵ�ص�___������������������������F�缫�ϵĵ缫��ӦʽΪ___��
��3�����õ绯ѧ���������ᣬ��ʹ�������������ֱ��ת��ΪSO3�������������ͬʱ���ܻ�ѧ���硣ͼ4Ϊ�绯ѧ����������Ĺ���ʾ��ͼ������Թ������������������ʣ��õ�����ܴ���O2-���ӡ�
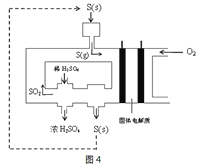
������ÿ����4.48LO2����״���£�����·��ת�Ƶ��ӵ���ĿΪ___��
��S(g)�ڸ�������SO3�ĵ缫��ӦʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ʒ�У��й����ʵ�������������ȷ���ǣ� ��
ѡ�� | ������Ʒ | ���� | ��Ҫ�ɷ� | ���� |
A |
| PP������������ƿ | �۱�ϩ | �ܹ�ʹ���Ը��������ɫ |
B |
| ���� | ��֬������ | ������ˮ��Һ�ʼ��� |
C |
| ���� | �����ǡ����Ǻ����� | ������ϡ����������¿�ˮ�����������Ǻ��� |
D |
| ���� | ¿��Ƥȥë���ƶ��ɵĽ��� | �ں��ʵ�ø���������ܹ�����ˮ�ⷴӦ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β����Ⱦ���������ŷŵķ�����ɵĻ�����Ⱦ����Ҫ��Ⱦ��Ϊһ����̼��̼�⻯�������������ȣ�������Ͷ���ֲ��Σ�����������β���������Ҫ�������о���Ч������ʹβ���е�һ����̼�͵������ﷴӦ��ת��������Ⱦ�ĵ����Ͷ�����̼��
�ش��������⣺
(1)��Co+�Ĵ������£�CO(g)��ԭN2O(g)�ķ�Ӧ���̺������仯��ͼ��ʾ(�ݳ���������Ϊ״̬�·����仯����ͼ����ȥ)����֪�ܷ�Ӧ�Ļ�ѧ����ʽΪ��CO(g)+N2O(g)![]() CO2(g)+N2(g)��
CO2(g)+N2(g)��
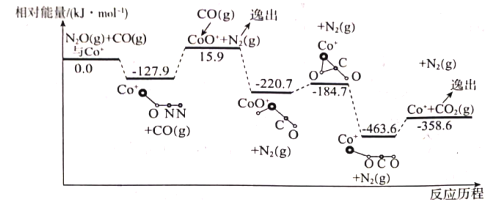
�÷�Ӧ���������У�
��һ����Co+(s)+N2O(g)![]() CoO+(s)+N2(g) ��H1=+15.9kJmol-1��
CoO+(s)+N2(g) ��H1=+15.9kJmol-1��
�ʶ�����___����H2=___��
����д�ڶ�����Ӧ���Ȼ�ѧ����ʽ�������ݷ�Ӧ����ͼ�����H2����ֵ��
�ڸ÷�Ӧ���������(���)Ϊ___��
(2)500�������£����ݻ���Ϊ2L�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ�����������Ӧ���������������±���
���� | ��Ӧ��Ͷ����� | ƽ��ʱ n(N2/mol) | �ﵽƽ������ʱ��/min | ƽ��ʱ�����仯/kJ |
�� | 1molCO��1molN2O | n1 | t1 | ����Q1 |
�� | 2molCO��2molN2O | n2 | t2 | ����Q2 |
�� | 2molCO2��2molN2 | n3 | t3 | ����Q3 |
��Q1+![]() ___358.6(����>����=������<����ͬ��t1___t2��
___358.6(����>����=������<����ͬ��t1___t2��
��500�������£��Һͱ�������������������N2O�����ʵ�������x(N2O)�뷴Ӧʱ��t�Ĺ�ϵ���±���
t/s | 0 | 20 | 40 | 60 | 80 | 120 | |
�� | x(N2O) | 0.5 | 0.32 | 0.20 | 0.12 | 0.088 | 0.07 |
�� | x(N2O) | 0 | 0.030 | 0.048 | 0.059 | 0.065 | 0.07 |
��������ʵ�������������������0~20sʱ���ڵĻ�ѧ��Ӧ����v(CO)=___���÷�Ӧ��ƽ�ⳣ��K��ֵΪ��___��(����3λ��Ч����)
�����ƲⲢ��ͼ�л�����������x(N2O)��ʱ��仯�Ĺ�ϵͼ���ǡ�ôﵽƽ��ʱ�̵��λ��___��

(3)����CO(g)��ԭN2O(g)�ķ�Ӧ��Ƴ���ͼ��ԭ���װ�ã���õ�������ĵ缫��ӦʽΪ___��
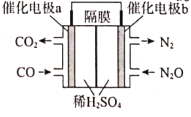
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ĵ���ƽ�ⳣ�������
���� | HCOOH | HClO | H2CO3 | H2SO3 |
����ƽ�� ������25�棩 | Ka��1.77��10��4 | Ka��4.0��10��8 | Ka1��4.3��10��7 Ka2��4.7��10��11 | Ka1��1.54��10��2 Ka2��1.02��10��7 |
��1�������¢�0.1mol��L-1HCOONa����0.1mol��L-1NaClO����0.1mol��L-1Na2CO3����0.1mol��L-1NaHCO3������Һ��pH�ɴ�С�Ĺ�ϵΪ________________�����������գ�
��2��Ũ�Ⱦ�Ϊ0.1 mol��L��1��Na2SO3��Na2CO3�Ļ����Һ�У�SO32-��CO32-��HSO3-��HCO3-Ũ�ȴӴ�С��˳��Ϊ________________��
��3���������ӷ���ʽ��ȷ����___________������ĸ����
A.2ClO-+H2O+CO2=2HClO+CO32- B.2HCOOH+CO32-=2HCOO-+H2O+CO2��
C.H2SO3+2HCOO-=2HCOOH+SO32- D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
��4��ij�¶ȣ�T�棩�µ���Һ�У�c��H+��=10-xmol��L-1��c��OH-=10-ymol��L-1��x��y�Ĺ�ϵ��ͼ��ʾ��
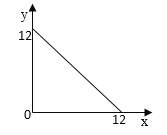
�ٴ��¶��£�0.01mol/L��NaOH��Һ��ˮ�������OH-Ũ��Ϊ_______��
���ڴ��¶��£�0.1mol��L-1��NaHSO4��Һ��0.1mol��L-1��Ba(OH)2��Һ���±��мס��ҡ���������ͬ��ʽ��ϣ�
�� | �� | �� | �� | |
0.1mol��L-1��Ba��OH��2 | 10 | 10 | 10 | 10 |
0.1mol��L-1��NaHSO4 | 5 | 10 | 15 | 20 |
����ʽ��Ϻ�������Һ��pHΪ____________��
���ҷ�ʽ��Ϻ��䷴Ӧ�����ӷ���ʽ��_________________��
������ʽ��Ϻ�������Һ��____________����������������������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com