
【题目】下面的各图中,表示2A(g)+B(g)![]() 2C(g)(正反应放热),这个可逆反应的正确图像为
2C(g)(正反应放热),这个可逆反应的正确图像为
A.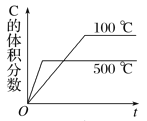 B.
B.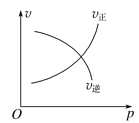
C.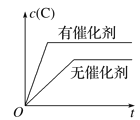 D.
D.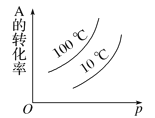
【答案】A
【解析】
A.温度高反应速率加快,正反应为放热反应,升高温度平衡逆向移动,C的体积分数减小;
B.交点前未到达平衡,压强增大平衡正向进行,交点处于平衡状态,再增大压强平衡向气体体积减小的方向移动,但瞬间正逆速率均增大;
C.催化剂不能使平衡移动;
D.正反应为放热反应,升高温度平衡逆向移动,A的转化率减小,正反应为气体体积减小反应,增大压强平衡正向移动,A的转化率增大.
A.温度高反应速率加快,到达平衡时间缩短,正反应为放热反应,升高温度平衡逆向移动,C的体积分数减小,图象与实际相符合,故A正确;
B.交点前未到达平衡,压强增大平衡正向进行,交点处于平衡状态,再增大压强平衡向气体体积减小的方向移动,但瞬间正逆速率均增大,图象与实际不相符,故B错误;
C.使用催化剂加快反应速率,缩短到达平衡的水解,但使用催化剂不使平衡移动,C的浓度不变,图象与实际不相符,故C错误;
D.正反应为放热反应,升高温度平衡逆向移动,A的转化率减小,正反应为气体体积减小反应,增大压强平衡正向移动,A的转化率增大,图象与实际不相符,故D错误,
故选A。


科目:高中化学 来源: 题型:
【题目】下列除杂试剂或操作选用不正确的是( )
物质(括号内为杂质) | 除杂试剂或操作 | |
A | Na2CO3晶体(NaHCO3) | 加热 |
B | CO2(HCl) | 饱和氯化钠溶液、浓H2SO4,洗气 |
C | Fe2O3(SiO2) | NaOH 溶液,过滤 |
D | 稀盐酸(Cl2) | 光照 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
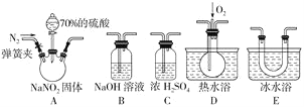
已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种大气污染物。工业尾气中含有H2S,会造成严重的环境污染;未脱除H2S的煤气,运输过程中还会腐蚀管道。
(1)干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。
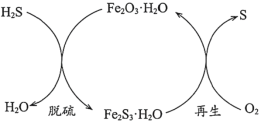
①下列说法正确的是____________(填序号)。
a.单质硫为淡黄色固体
b.脱硫反应为3H2S+Fe2O3·H2O=3H2O+Fe2S3·H2O
c.再生过程中,硫元素被还原
d.脱硫过程中,增大反应物的接触面积可提高脱硫效率
②从安全环保的角度考虑,再生过程需控制反应温度不能过高的原因是_______。
(2)电化学溶解一沉淀法是一种回收利用H2S的新方法,其工艺原理如下图所示。
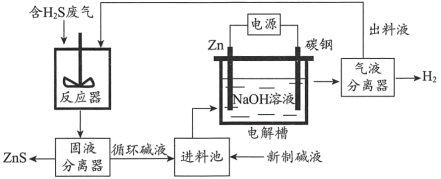
已知: Zn与强酸、强碱都能反应生成H2;Zn(II)在过量的强碱溶液中以[Zn(OH)4]2-形式存在。
①锌棒连接直流电源的____________(填“正极”或“负极”)。
②反应器中反应的离子方程式为____________。
③电解槽中,没接通电源时已经有H2产生,用化学用语解释原因:___________。
(3)常用碘量法测定煤气中H2S的含量,其实验过程如下:
i.将10L煤气通入盛有100mL锌氨络合液的洗气瓶中,将其中的H2S全部转化为ZnS沉淀,过滤;
ii.将带有沉淀的滤纸加入盛有15mL 0.1mol/L碘标准液、200mL水和10mL盐酸的碘量瓶中,盖上瓶塞,摇动碘量瓶至瓶内滤纸摇碎,置于暗处反应10 min后,用少量水冲洗瓶壁和瓶塞。(已知:ZnS+I2=ZnI2+S)
iii.用0.1mol/L Na2S2O3标准液滴定,待溶液呈淡黄色时,加入1mL淀粉指示剂,继续滴定至终点。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①i中,将煤气中的H2S转化为ZnS的目的是____________。
②滴定终点的现象是__________________。
③若消耗Na2S2O3标准液的体积为20mL,则煤气中![]() 的含量为_______________mg/m3。
的含量为_______________mg/m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,发生可逆反应:3A(g)![]() 3B+C(正反应为吸热反应),平衡时,升高温度,气体的平均相对分子质量有变小的趋势,则下列判断中正确的是
3B+C(正反应为吸热反应),平衡时,升高温度,气体的平均相对分子质量有变小的趋势,则下列判断中正确的是
A.B和C可能都是固体B.B和C一定都是气体
C.若C为固体,则B一定是气体D.B和C不可能都是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g)![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列叙述正确的是
①增加A的量,平衡向逆反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应mA(g)![]() nB(g)+pC(s)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
nB(g)+pC(s)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.m<n+pB.物质A的转化率减小
C.物质B的质量分数减小D.平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[Fe(C5H5)2,结构简式为 ,广泛应用于航天、化工等领域中。实验室制备二茂铁的装置如图所示。
,广泛应用于航天、化工等领域中。实验室制备二茂铁的装置如图所示。
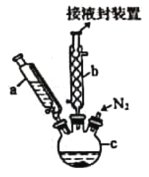
已知:①二茂铁熔点是173 ℃,在100 ℃时开始由固体直接变为气体;沸点是249 ℃。
②制备二茂铁的反应原理为2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O。
实验步骤为:
①在三颈烧瓶中加入16.8 g粉末状的KOH,并从仪器a中加入60 mL无水乙醚到烧瓶中,充分搅拌,同时通氮气5 min左右;
②再从仪器a滴入13.9 mL新蒸馏的环戊二烯(C5H6,密度为0.95 g/cm3),搅拌;
③将25.4 g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25 mL装入仪器a中,慢慢滴入仪器c中,45 min滴完,继续搅拌45 min;
④再从仪器a加入25 mL无水乙醚,搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得到橙黄色溶液;
⑥蒸发橙黄色溶液,得到二茂铁粗产品;
⑦二茂铁粗产品的提纯。
回答下列问题:
(1)仪器b的名称是________________。
(2)步骤①中通入氮气的目的是________________。
(3)仪器c的适宜容积应为________________(填标号)。
A. 100 mL B. 250 mL C. 500 mL D. 1000 mL
(4)步骤⑤用盐酸洗涤的目的是________________.
(5)步骤⑦的实验装置如图所示,二茂铁在扎有小孔的滤纸上凝结,该分离提纯方法的名称是________________,装置中棉花的作用是________________。
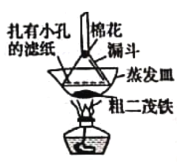
(6)为了确认得到的是二茂铁,还需要进行的一项简单实验是________________。
(7)若最终制得纯净的二茂铁11.16 g,则该实验的产率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有较多的科研人员在研究甲醛的氧化,有人提出HCHO(![]() )与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如图(图中只画出了HAP的部分结构)。
)与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如图(图中只画出了HAP的部分结构)。

下列说法正确的是( )
A.该反应的氧化产物是CO2
B.HCHO在反应过程中有C=O键发生断裂
C.根据图示信息,CO2分子中的氧原子全部来自O2
D.HAP能提高HCHO与O2应的活化能,但不改变反应路径
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com