
ΓΨΧβΡΩΓΩΈ“Ιζ”–ΫœΕύΒΡΩΤ―–»Υ‘±‘Ύ―–ΨΩΦΉ»©ΒΡ―θΜ·Θ§”–»ΥΧα≥ωHCHO(![]() )”κO2‘Ύτ«ΜυΝΉΜ“ ·(HAP)±μΟφ¥ΏΜ·―θΜ·…ζ≥…CO2ΓΔH2OΒΡάζ≥ΧΘ§ΗΟάζ≥Χ Ψ“βΆΦ»γΆΦΘ®ΆΦ÷–÷ΜΜ≠≥ωΝΥHAPΒΡ≤ΩΖ÷ΫαΙΙΘ©ΓΘ
)”κO2‘Ύτ«ΜυΝΉΜ“ ·(HAP)±μΟφ¥ΏΜ·―θΜ·…ζ≥…CO2ΓΔH2OΒΡάζ≥ΧΘ§ΗΟάζ≥Χ Ψ“βΆΦ»γΆΦΘ®ΆΦ÷–÷ΜΜ≠≥ωΝΥHAPΒΡ≤ΩΖ÷ΫαΙΙΘ©ΓΘ

œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
A.ΗΟΖ¥”ΠΒΡ―θΜ·≤ζΈο «CO2
B.HCHO‘ΎΖ¥”ΠΙΐ≥Χ÷–”–C=OΦϋΖΔ…ζΕœΝ―
C.ΗυΨίΆΦ Ψ–≈œΔΘ§CO2Ζ÷Ή”÷–ΒΡ―θ‘≠Ή”»Ϊ≤Ωά¥Ή‘O2
D.HAPΡήΧαΗΏHCHO”κO2”ΠΒΡΜνΜ·ΡήΘ§ΒΪ≤ΜΗΡ±δΖ¥”Π¬ΖΨΕ
ΓΨ¥πΑΗΓΩA
ΓΨΫβΈωΓΩ
AΘ°”…ΧβΗ…–≈œΔΘ§HCHO”κO2‘Ύτ«ΜυΝΉΜ“ ·(HAP)±μΟφ¥ΏΜ·―θΜ·…ζ≥…CO2ΓΔH2OΘ§HCHO÷–ΒΡC¥”0Φέ…ΐΗΏ÷Ν+4ΦέΘ§ΉςΜΙ‘≠ΦΝΘ§‘ρΕ‘”Π…ζ≥…ΒΡCO2ΈΣ―θΜ·≤ζΈοΘ§A―Γœν’ΐ»ΖΘΜ
BΘ°ΗυΨίΆΦ ΨΘ§’ϊΗωΖ¥”ΠΙΐ≥Χ÷–Θ§HCHO‘ΎΖ¥”ΠΙΐ≥Χ÷–”–CΓΣHΦϋΒΡΕœΝ―ΚΆC=OΦϋΒΡ–Έ≥…Θ§B―Γœν¥μΈσΘΜ
CΘ°”…ΆΦ ΨΩ…÷ΣΘ§CO2Ζ÷Ή”÷–―θ‘≠Ή”“Μ≤ΩΖ÷ά¥Ή‘”ΎO2Θ§“Μ≤ΩΖ÷ΜΙά¥Ή‘”ΎHCHOΘ§C―Γœν¥μΈσΘΜ
DΘ°HAP‘ΎΖ¥”Π÷–Ής¥ΏΜ·ΦΝΘ§Ω…ΫΒΒΆHCHO”κO2”ΠΒΡΜνΜ·ΡήΘ§D―Γ¥μΈσΘΜ
¥πΑΗ―ΓAΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬ΟφΒΡΗςΆΦ÷–Θ§±μ Ψ2AΘ®gΘ©ΘΪBΘ®gΘ©![]() 2CΘ®gΘ©Θ®’ΐΖ¥”ΠΖ≈»»Θ©Θ§’βΗωΩ…ΡφΖ¥”ΠΒΡ’ΐ»ΖΆΦœώΈΣ
2CΘ®gΘ©Θ®’ΐΖ¥”ΠΖ≈»»Θ©Θ§’βΗωΩ…ΡφΖ¥”ΠΒΡ’ΐ»ΖΆΦœώΈΣ
A.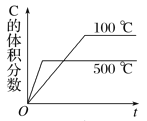 B.
B.
C. D.
D.
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–…ζΜν≥ΘΦϊ”ΟΤΖ÷–Θ§”–ΙΊΈο÷ ΒΡ–‘÷ Οη ω≤Μ’ΐ»ΖΒΡ «Θ® Θ©
―Γœν | …ζΜν”ΟΤΖ | Οϊ≥Τ | ÷ς“Σ≥…Ζ÷ | –‘÷ |
A |
| PPΥήΝœ÷ΤΉςΒΡΡΧΤΩ | Ψέ±ϊœ© | ΡήΙΜ ΙΥα–‘ΗΏΟΧΥαΦΊΆ …Ϊ |
B |
| Ζ ‘μ | ΗΏΦΕ÷§ΖΨΥαΡΤ | Ζ ‘μΒΡΥ°»ή“Κ≥ Φν–‘ |
C |
| ΖδΟέ | ΤœΧ―Χ«ΓΔΙϊΧ«ΚΆ’αΧ« | ’αΧ«‘ΎœΓΝρΥαΒΡΉς”Οœ¬Ω…Υ°Ϋβ…ζ≥…ΤœΧ―Χ«ΚΆΙϊΧ« |
D |
| ΑΔΫΚ | ¬ΩΒΡΤΛ»ΞΟΪΚσΑΨ÷ΤΕχ≥…ΒΡΫΚΩι | ‘ΎΚœ ΒΡΟΗΒΡΉς”Οœ¬ΡήΙΜΖΔ…ζΥ°ΫβΖ¥”Π |
A.AB.BC.CD.D
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΤϊ≥ΒΈ≤ΤχΈέ»Ψ «”…Τϊ≥Β≈≈Ζ≈ΒΡΖœΤχ‘λ≥…ΒΡΜΖΨ≥Έέ»ΨΓΘ÷ς“ΣΈέ»ΨΈοΈΣ“Μ―θΜ·ΧΦΓΔΧΦ«βΜ·ΚœΈοΓΔΒΣ―θΜ·ΚœΈοΒ»Θ§Ε‘»ΥάύΚΆΕ·ΓΔ÷≤ΈοΈΘΚΠ…θ¥σΓΘΫβΨωΤϊ≥ΒΈ≤ΤχΈ ΧβΒΡ÷ς“ΣΖΫΖ® «―–ΨΩΗΏ–ߥΏΜ·ΦΝ¥Ό ΙΈ≤Τχ÷–ΒΡ“Μ―θΜ·ΧΦΚΆΒΣ―θΜ·ΈοΖ¥”ΠΘ§ΉΣΜ·≥…ΈόΈέ»ΨΒΡΒΣΤχΚΆΕΰ―θΜ·ΧΦΓΘ
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)‘ΎCo+ΒΡ¥ΏΜ·Ής”Οœ¬Θ§CO(g)ΜΙ‘≠N2O(g)ΒΡΖ¥”Πάζ≥ΧΚΆΡήΝΩ±δΜ·»γΆΦΥυ Ψ(“ί≥ωΚσΈο÷ »œΈΣΉ¥Χ§œ¬ΖΔ…ζ±δΜ·Θ§‘ΎΆΦ÷–¬‘»Ξ)ΓΘ“―÷ΣΉήΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣΘΚCO(g)+N2O(g)![]() CO2(g)+N2(g)ΓΘ
CO2(g)+N2(g)ΓΘ
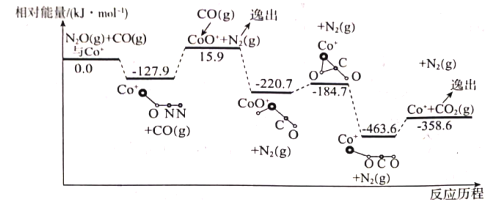
ΗΟΖ¥”ΠΖ÷ΝΫ≤ΫΫχ––ΘΚ
ΒΎ“Μ≤ΫΘΚCo+(s)+N2O(g)![]() CoO+(s)+N2(g) ΓςH1=+15.9kJmol-1ΘΜ
CoO+(s)+N2(g) ΓςH1=+15.9kJmol-1ΘΜ
σ Εΰ≤ΫΘΚ___ΘΜΓςH2=___ΘΜ
ΔΌΧν–¥ΒΎΕΰ≤ΫΖ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ ΫΘ§≤ΔΗυΨίΖ¥”Πάζ≥ΧΆΦΦΤΥψΓςH2ΒΡ ΐ÷ΒΓΘ
ΔΎΗΟΖ¥”ΠΒΡΉνΗΏΡήάί(ΜνΜ·Ρή)ΈΣ___ΓΘ
(2)500ΓφΧθΦΰœ¬Θ§‘Ύ»ίΜΐΨυΈΣ2LΒΡ»ΐΗωΟή±’»ίΤς÷–Θ§Α¥≤ΜΆ§ΖΫ ΫΆΕ»κΖ¥”ΠΈοΘ§ΖΔ…ζ…œ ωΖ¥”ΠΘ§≤βΒΟœύΙΊ ΐΨί»γœ¬±μΘΚ
»ίΤς | Ζ¥”ΠΈοΆΕ»κΒΡΝΩ | ΤΫΚβ ± n(N2/mol) | ¥οΒΫΤΫΚβΥυ–η ±Φδ/min | ΤΫΚβ ±ΡήΝΩ±δΜ·/kJ |
ΦΉ | 1molCOΚΆ1molN2O | n1 | t1 | Ζ≈»»Q1 |
““ | 2molCOΚΆ2molN2O | n2 | t2 | Ζ≈»»Q2 |
±ϊ | 2molCO2ΚΆ2molN2 | n3 | t3 | Έϋ»»Q3 |
ΔΌQ1+![]() ___358.6(ΧνΓΑ>Γ±ΓΑ=Γ±ΜρΓΑ<Γ±œ¬Ά§Θ§t1___t2ΘΜ
___358.6(ΧνΓΑ>Γ±ΓΑ=Γ±ΜρΓΑ<Γ±œ¬Ά§Θ§t1___t2ΘΜ
ΔΎ500ΓφΧθΦΰœ¬Θ§““ΚΆ±ϊΝΫ»ίΤςΘ§ΤχΧεΜλΚœΈο÷–N2OΒΡΈο÷ ΒΡΝΩΖ÷ ΐx(N2O)”κΖ¥”Π ±ΦδtΒΡΙΊœΒ»γœ¬±μΘΚ
t/s | 0 | 20 | 40 | 60 | 80 | 120 | |
““ | x(N2O) | 0.5 | 0.32 | 0.20 | 0.12 | 0.088 | 0.07 |
±ϊ | x(N2O) | 0 | 0.030 | 0.048 | 0.059 | 0.065 | 0.07 |
ΗυΨί…œ ω Β―ιΫαΙϊΘ§ΦΤΥψ≥ω““»ίΤς÷–0~20s ±ΦδΡΎΒΡΜ·―ßΖ¥”ΠΥΌ¬ v(CO)=___ΘΜΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐK ΐ÷ΒΈΣΘΚ___ΘΜ(±ΘΝτ3ΈΜ”––ß ΐΉ÷)
Δέ«κΆΤ≤β≤Δ‘ΎΆΦ÷–Μ≠≥ωΦΉ»ίΤς÷–x(N2O)Υφ ±Φδ±δΜ·ΒΡΙΊœΒΆΦœσΘ§±ξ≥ω«ΓΚΟ¥οΒΫΤΫΚβ ±ΩΧΒψΒΡΈΜ÷Ο___ΓΘ

(3)»τΫΪCO(g)ΜΙ‘≠N2O(g)ΒΡΖ¥”Π…ηΦΤ≥…»γΆΦΒΡ‘≠Βγ≥ΊΉΑ÷ΟΘ§‘ρΗΟΒγ≥Ί’ΐΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣ___ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷Σ―«ΝΉΥα(H3PO3)ΒΡΫαΙΙ»γΆΦ![]() Θ§ΨΏ”–«ΩΜΙ‘≠–‘ΒΡΕΰ‘Σ»θΥαΘ§Ω…“‘±Μ“χάκΉ”―θΜ·ΈΣΝΉΥαΓΘ
Θ§ΨΏ”–«ΩΜΙ‘≠–‘ΒΡΕΰ‘Σ»θΥαΘ§Ω…“‘±Μ“χάκΉ”―θΜ·ΈΣΝΉΥαΓΘ
Θ®1Θ©“―÷Σ―«ΝΉΥαΩ…”…PCl3Υ°ΫβΕχ≥…Θ§«κ–¥≥ωœύ”ΠΒΡΖΫ≥Χ Ϋ___ΘΜ
Θ®2Θ©Na2HPO3 «________(ΧνΓΑ’ΐ―ΈΓ±ΜρΓΑΥα Ϋ―ΈΓ±)ΘΜ
Θ®3Θ©―«ΝΉΥα”κ“χάκΉ”Ζ¥”Π ±―θΜ·ΦΝ”κΜΙ‘≠ΦΝΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ______________ΘΜ
Θ®4Θ©Ρ≥Έ¬Ε»œ¬Θ§0.10molL-1ΒΡH3PO3»ή“ΚΒΡpHΈΣ1.6Θ§Φ¥c(H+)=2.5ΓΝ10-2molL-1Θ§ΗΟΈ¬Ε»œ¬H3PO3ΒΡ“ΜΦΕΒγάκΤΫΚβ≥Θ ΐKa1=______ΘΜ(H3PO3ΒΎΕΰ≤ΫΒγάκΚω¬‘≤ΜΦΤΘ§ΫαΙϊ±ΘΝτΝΫΈΜ”––ß ΐΉ÷)
Θ®5Θ©œρH3PO3»ή“Κ÷–ΒΈΦ”NaOH»ή“Κ÷Ν÷––‘Θ§ΥυΒΟ»ή“Κ÷–ΘΚc(Na+)_____c(H2PO3-)+2c(HPO32-)(ΧνΓΑΘΨΓ±ΓΔΓΑΘΦΓ±ΜρΓΑ=Γ±)ΘΜ
Θ®6Θ©œρΡ≥≈®Ε»ΒΡ―«ΝΉΥα÷–ΒΈΦ”NaOH»ή“ΚΘ§ΤδpH”κ»ή“Κ÷–ΒΡH3PO3ΓΔH2PO3ΓΣΓΔHPO32ΓΣΒΡΈο÷ ΒΡΝΩΖ÷ ΐa(X)Θ®ΤΫΚβ ±Ρ≥Έο÷÷ΒΡ≈®Ε»”κ’ϊΗωΈο÷÷≈®Ε»÷°ΚΆΒΡ±»÷Β)ΒΡΙΊœΒ»γΆΦΥυ ΨΓΘ
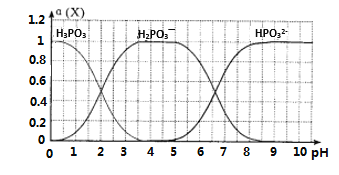
“‘Ζ”ΧΣΈΣ÷Η ΨΦΝΘ§Β±»ή“Κ”…Έό…Ϊ±δΈΣ«≥Κλ…Ϊ ±Θ§ΖΔ…ζ÷ς“ΣΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ «____________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩNAΈΣΑΔΖϋΦ”Β¬¬ό≥Θ ΐΒΡ÷ΒΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
A.±ξΉΦΉ¥Ωωœ¬Θ§2.24LCH3OHΖ÷Ή”÷–Ι≤ΦέΦϋΒΡ ΐΡΩΈΣ0.5NA
B.100g46%ΒΡΦΉΥα(HCOOH)Υ°»ή“Κ÷–ΥυΚ§ΒΡ―θ‘≠Ή” ΐΡΩΈΣ5NA
C.lmolΧζΖέΗΏΈ¬œ¬”κΉψΝΩΥ°’τΤχΖ¥”ΠΘ§ΉΣ“ΤΒγΉ” ΐΈΣ3NA
D.2molSO2ΚΆlmolO2‘Ύ¥ΏΜ·ΦΝΉς”Οœ¬≥δΖ÷Ζ¥”ΠΥυΒΟΖ÷Ή”Ήή ΐΈΣ2NA
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ Β―ι “”Ο±ξΉΦ―ΈΥα»ή“Κ≤βΕ®Ρ≥NaOH»ή“ΚΒΡ≈®Ε»Θ§”ΟΦΉΜυ≥»Ής÷Η ΨΦΝΘ§œ¬Ν–≤ΌΉς÷–Ω…Ρή Ι≤βΕ®ΫαΙϊΤΪΒΆΒΡ «Θ® Θ©
A.Υα ΫΒΈΕ®Ιή‘ΎΉΑΥα“Κ«ΑΈ¥”Ο±ξΉΦ―ΈΥα»ή“Κ»σœ¥2ΓΪ3¥Έ
B.ΩΣ Φ Β―ι ±Υα ΫΒΈΕ®ΙήΦβΉλ≤ΩΖ÷”–Τχ≈ίΘ§‘ΎΒΈΕ®Ιΐ≥Χ÷–Τχ≈ίœϊ ß
C.ΉΕ–ΈΤΩΡΎ»ή“Κ―’…Ϊ±δΜ·”…ΜΤ…Ϊ±δ≥»…ΪΘ§ΝΔΦ¥Φ«œ¬ΒΈΕ®Ιή“ΚΟφΥυ‘ΎΩΧΕ»
D. ΔNaOH»ή“ΚΒΡΉΕ–ΈΤΩΒΈΕ®«Α”ΟNaOH»ή“Κ»σœ¥2ΓΪ3¥Έ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≤ΩΖ÷»θΥαΒΡΒγάκΤΫΚβ≥Θ ΐ»γ±μΘΚ
»θΥα | HCOOH | HClO | H2CO3 | H2SO3 |
ΒγάκΤΫΚβ ≥Θ ΐΘ®25ΓφΘ© | KaΘΫ1.77ΓΝ10Θ≠4 | KaΘΫ4.0ΓΝ10Θ≠8 | Ka1ΘΫ4.3ΓΝ10Θ≠7 Ka2ΘΫ4.7ΓΝ10Θ≠11 | Ka1ΘΫ1.54ΓΝ10Θ≠2 Ka2ΘΫ1.02ΓΝ10Θ≠7 |
Θ®1Θ© “Έ¬œ¬ΔΌ0.1molΓΛL-1HCOONaΘΜΔΎ0.1molΓΛL-1NaClOΘΜΔέ0.1molΓΛL-1Na2CO3ΘΜΔή0.1molΓΛL-1NaHCO3ΥΡ÷÷»ή“ΚΒΡpH”…¥σΒΫ–ΓΒΡΙΊœΒΈΣ________________ΓΘΘ®”Ο–ρΚ≈ΧνΩ’Θ©
Θ®2Θ©≈®Ε»ΨυΈΣ0.1 molΓΛLΘ≠1ΒΡNa2SO3ΚΆNa2CO3ΒΡΜλΚœ»ή“Κ÷–Θ§SO32-ΓΔCO32-ΓΔHSO3-ΓΔHCO3-≈®Ε»¥”¥σΒΫ–ΓΒΡΥ≥–ρΈΣ________________ΓΘ
Θ®3Θ©œ¬Ν–άκΉ”ΖΫ≥Χ Ϋ’ΐ»ΖΒΡ «___________Θ®ΧνΉ÷ΡΗΘ©ΓΘ
A.2ClO-+H2O+CO2=2HClO+CO32- B.2HCOOH+CO32-=2HCOO-+H2O+CO2Γϋ
C.H2SO3+2HCOO-=2HCOOH+SO32- D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
Θ®4Θ©Ρ≥Έ¬Ε»Θ®TΓφΘ©œ¬ΒΡ»ή“Κ÷–Θ§cΘ®H+Θ©=10-xmolΓΛL-1Θ§cΘ®OH-=10-ymolΓΛL-1Θ§x”κyΒΡΙΊœΒ»γΆΦΥυ ΨΓΘ
ΔΌ¥ΥΈ¬Ε»œ¬Θ§0.01mol/LΒΡNaOH»ή“Κ÷–Υ°Βγάκ≥ωΒΡOH-≈®Ε»ΈΣ_______ΓΘ
ΔΎ‘Ύ¥ΥΈ¬Ε»œ¬Θ§0.1molΓΛL-1ΒΡNaHSO4»ή“Κ”κ0.1molΓΛL-1ΒΡBa(OH)2»ή“ΚΑ¥œ¬±μ÷–ΦΉΓΔ““ΓΔ±ϊΓΔΕΓ≤ΜΆ§ΖΫ ΫΜλΚœΘΚ
ΦΉ | ““ | ±ϊ | ΕΓ | |
0.1molΓΛL-1ΒΡBaΘ®OHΘ©2 | 10 | 10 | 10 | 10 |
0.1molΓΛL-1ΒΡNaHSO4 | 5 | 10 | 15 | 20 |
Α¥ΦΉΖΫ ΫΜλΚœΚσΘ§ΥυΒΟ»ή“ΚΒΡpHΈΣ____________ΘΜ
Α¥““ΖΫ ΫΜλΚœΚσΘ§ΤδΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚ_________________ΓΘ
Α¥ΕΓΖΫ ΫΜλΚœΚσΘ§ΥυΒΟ»ή“Κœ‘____________Θ®ΧνΓΑΥαΓ±ΓΑΦνΓ±ΜρΓΑ÷–Γ±Θ©–‘
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΑ± «÷Τ‘λΜ·Ζ ΒΡ÷Ί“Σ‘≠ΝœΘ§»γΆΦΈΣΙΛ“ΒΚœ≥…Α±ΒΡΝς≥ΧΆΦΓΘœ¬Ν–”–ΙΊΥΒΖ®¥μΈσΒΡ «
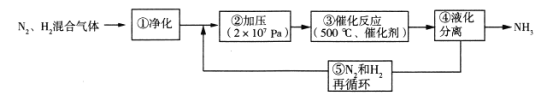
A.ΙΛ“Β…œ÷ΤΒΣΤχ“ΜΑψ”ΟΖ÷άκ“ΚΧ§Ω’ΤχΖ®
B.≤Ϋ÷ηΔΎΓΔΔέΓΔΔήΓΔΔίΨυ”–άϊ”ΎΧαΗΏΖ¥”ΠΈοΒΡΤΫΚβΉΣΜ·¬
C.≤Ϋ÷ηΔΌ÷–ΓΑΨΜΜ·Γ±N2ΓΔH2ΜλΚœΤχΧεΩ…“‘Ζά÷Ι¥ΏΜ·ΦΝ÷–ΕΨ
D.≤Ϋ÷ηΔέ÷–Έ¬Ε»―Γ‘ώ500ΓφΘ§÷ς“Σ «ΩΦ¬«¥ΏΜ·ΦΝΒΡΜν–‘
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com