
【题目】配制一定物质的量浓度的溶液,几个关键实验步骤和操作如图:

(1)现需要94 mL 0.10 mol·L-1 Na2CO3溶液,进行现场配制。上述实验步骤A~F正确的实验次序为_______________________(填字母)。步骤E中将一玻璃仪器上下颠倒数次,写出该仪器的名称_________________。
(2)步骤C通常称为溶解,步骤A通常称为_________。
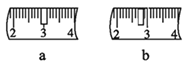
(3)用Na2CO3·10H2O来配制该溶液,托盘天平称取样品,游码需要打在图示________(填a或b)位置,若称量前晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏_______(填“大”或“小”或“无影响”)。
【答案】CBDFAE 100 mL容量瓶 定容 a 大
【解析】
本题考察一定物质的量浓度溶液配制,难度不大,考生运用所学知识答题即可。
(1)配制一定物质的量浓度溶液的操作步骤为:计算→称量→溶解→移液→洗涤→定容→摇匀→装瓶;上述实验步骤中,A为定容,B为移液,C为溶解,D为洗涤,E为摇匀,F为洗涤后的加水,故正确的实验次序为CBDFAE;E为容量瓶,由于要配制94mL的溶液,需要使用100mL的规格,故E为100mL容量瓶;
(2)A为定容;
(3)实验需要使用100mL容量瓶,则n(Na2CO3·10H2O)=0.1L×0.1mol·L-1=0.01mol,m(Na2CO3·10H2O)=0.01mol×286g·mol-1=2.9g,则需要用游码称0.9g,故选a;称量前晶体已经有一部分失去了结晶水,则称得的晶体中n(Na2CO3)偏大,故所配制的溶液浓度偏大。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在2 L恒容密闭容器中充入![]() 、
、![]() ,在一定条件下发生如下反应:
,在一定条件下发生如下反应:![]()
![]() ;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
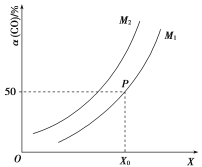
A.工业上,利用上述反应合成甲醇,温度越高越好
B.图象中X代表温度,![]()
C.图象中P点代表的平衡常数K为![]()
D.温度和容积不变,再充入![]() 、1 mol CO,达到平衡时CO的转化率减小
、1 mol CO,达到平衡时CO的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂试剂或操作选用不正确的是( )
物质(括号内为杂质) | 除杂试剂或操作 | |
A | Na2CO3晶体(NaHCO3) | 加热 |
B | CO2(HCl) | 饱和氯化钠溶液、浓H2SO4,洗气 |
C | Fe2O3(SiO2) | NaOH 溶液,过滤 |
D | 稀盐酸(Cl2) | 光照 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种一元酸溶液各1mL, 分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示, 则下列说法正确的是

A. A、B两种酸溶液物质的量浓度一定相等
B. 稀释后A酸溶液的酸性比B酸溶液强
C. a = 5时, A是弱酸, B是强酸
D. 若A、B都是弱酸, 则5 > a > 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 2×10﹣5 |
HClO | HClO | 3.0×10﹣8 |
H2CO3 | H2CO3 HCO3﹣ | K1=4.4×10﹣7 K2=5.61×10﹣11 |
H3PO4 | H3PO4 H2PO4﹣ HPO42﹣ | K1=7.1×10﹣3 K2=6.3×10﹣8 K3=4.2×10﹣13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3﹣、H3PO4、H2PO4﹣、HPO42﹣都看作是酸,则它们酸性最强的是_______(填化学式,下同),最弱的是________。
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为_______。
(3)求出该温度下,0.10molL﹣
(4)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是____。
A.c(H+) B.c(H+)c(CH3COO﹣) C.c(H+)c(OH﹣) D.c(OH﹣)/c(H+)
(5)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1_____V2( 填“>”、“<”或“=”)。
(6)下列四种离子结合H+能力最强的是_______。
A.HCO3﹣ B.CO32﹣ C.ClO﹣ D.CH3COO﹣
(7)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是(_________)
A.Va>10Vb B.Va<10Vb C.Vb <10 Va D.Vb>10Va
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室药品必须按规定存放,下列对错误存放后出现现象的解释合理的是( )
A.石灰水敞口存放,出现白色固体:![]()
B.浓硝酸存放于无色细口瓶中,颜色变黄:![]()
C.酸化的硫酸亚铁溶液长时间存放,溶液变黄:![]()
D.将氨水和浓盐酸存放在同一个药品柜中,柜壁出现白色固体:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。

已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种大气污染物。工业尾气中含有H2S,会造成严重的环境污染;未脱除H2S的煤气,运输过程中还会腐蚀管道。
(1)干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。
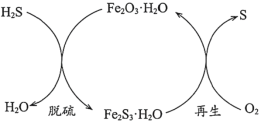
①下列说法正确的是____________(填序号)。
a.单质硫为淡黄色固体
b.脱硫反应为3H2S+Fe2O3·H2O=3H2O+Fe2S3·H2O
c.再生过程中,硫元素被还原
d.脱硫过程中,增大反应物的接触面积可提高脱硫效率
②从安全环保的角度考虑,再生过程需控制反应温度不能过高的原因是_______。
(2)电化学溶解一沉淀法是一种回收利用H2S的新方法,其工艺原理如下图所示。
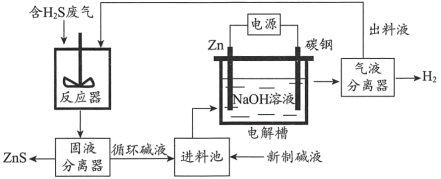
已知: Zn与强酸、强碱都能反应生成H2;Zn(II)在过量的强碱溶液中以[Zn(OH)4]2-形式存在。
①锌棒连接直流电源的____________(填“正极”或“负极”)。
②反应器中反应的离子方程式为____________。
③电解槽中,没接通电源时已经有H2产生,用化学用语解释原因:___________。
(3)常用碘量法测定煤气中H2S的含量,其实验过程如下:
i.将10L煤气通入盛有100mL锌氨络合液的洗气瓶中,将其中的H2S全部转化为ZnS沉淀,过滤;
ii.将带有沉淀的滤纸加入盛有15mL 0.1mol/L碘标准液、200mL水和10mL盐酸的碘量瓶中,盖上瓶塞,摇动碘量瓶至瓶内滤纸摇碎,置于暗处反应10 min后,用少量水冲洗瓶壁和瓶塞。(已知:ZnS+I2=ZnI2+S)
iii.用0.1mol/L Na2S2O3标准液滴定,待溶液呈淡黄色时,加入1mL淀粉指示剂,继续滴定至终点。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①i中,将煤气中的H2S转化为ZnS的目的是____________。
②滴定终点的现象是__________________。
③若消耗Na2S2O3标准液的体积为20mL,则煤气中![]() 的含量为_______________mg/m3。
的含量为_______________mg/m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[Fe(C5H5)2,结构简式为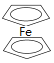 ,广泛应用于航天、化工等领域中。实验室制备二茂铁的装置如图所示。
,广泛应用于航天、化工等领域中。实验室制备二茂铁的装置如图所示。
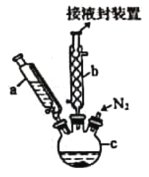
已知:①二茂铁熔点是173 ℃,在100 ℃时开始由固体直接变为气体;沸点是249 ℃。
②制备二茂铁的反应原理为2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O。
实验步骤为:
①在三颈烧瓶中加入16.8 g粉末状的KOH,并从仪器a中加入60 mL无水乙醚到烧瓶中,充分搅拌,同时通氮气5 min左右;
②再从仪器a滴入13.9 mL新蒸馏的环戊二烯(C5H6,密度为0.95 g/cm3),搅拌;
③将25.4 g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25 mL装入仪器a中,慢慢滴入仪器c中,45 min滴完,继续搅拌45 min;
④再从仪器a加入25 mL无水乙醚,搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得到橙黄色溶液;
⑥蒸发橙黄色溶液,得到二茂铁粗产品;
⑦二茂铁粗产品的提纯。
回答下列问题:
(1)仪器b的名称是________________。
(2)步骤①中通入氮气的目的是________________。
(3)仪器c的适宜容积应为________________(填标号)。
A. 100 mL B. 250 mL C. 500 mL D. 1000 mL
(4)步骤⑤用盐酸洗涤的目的是________________.
(5)步骤⑦的实验装置如图所示,二茂铁在扎有小孔的滤纸上凝结,该分离提纯方法的名称是________________,装置中棉花的作用是________________。
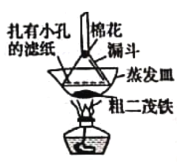
(6)为了确认得到的是二茂铁,还需要进行的一项简单实验是________________。
(7)若最终制得纯净的二茂铁11.16 g,则该实验的产率为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com