
【题目】在2 L恒容密闭容器中充入![]() 、
、![]() ,在一定条件下发生如下反应:
,在一定条件下发生如下反应:![]()
![]() ;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
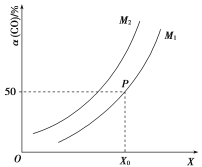
A.工业上,利用上述反应合成甲醇,温度越高越好
B.图象中X代表温度,![]()
C.图象中P点代表的平衡常数K为![]()
D.温度和容积不变,再充入![]() 、1 mol CO,达到平衡时CO的转化率减小
、1 mol CO,达到平衡时CO的转化率减小
【答案】C
【解析】
A.该反应的正反应是放热反应,温度升高,平衡向左移动,甲醇的产率降低,应根据催化剂来选择合适的温度,A项错误;
B.该反应的正反应是放热反应,又是气体分子数减小的反应,从图象看出,随着X增大,CO的转化率增大,所以X代表压强,M代表温度,温度越高,CO的平衡转化率越低,所以![]() ,B项错误;
,B项错误;
C.P点时CO的转化率为50%,用“三段式”法进行计算:
![]()
起始浓度/(![]() ) 1 0.5 0
) 1 0.5 0
变化浓度/(![]() ) 0.5 0.25 0.25
) 0.5 0.25 0.25
平衡浓度/(![]() ) 0.5 0.25 0.25
) 0.5 0.25 0.25
![]() (单位可省),C项正确;
(单位可省),C项正确;
D.温度不变,平衡常数不变,容积不变,再充入![]() 、1 mol CO,相当于增大压强,平衡向右移动,
、1 mol CO,相当于增大压强,平衡向右移动,![]() 、CO的转化率都增大,D项错误。
、CO的转化率都增大,D项错误。
答案选C。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组用下图装置探究氨的催化氧化。
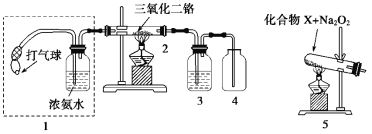
(1)氨催化氧化的化学方程式为____。
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是__(填“吸热”或“放热”)反应。
(3)为实现氨催化氧化,也可用装置5替换装置1,若化合物X为NH4HCO3,NH4HCO3发生分解反应,该反应的化学方程式为___,部分产物和Na2O2反应得到O2,使NH3和O2混合催化氧化,装置4中可以观察到有红棕色气体生成,红棕色气体生成的化学方程式为___。
(4)为保证在装置4中观察到红棕色气体,装置3中应装入___。若取消装置3,在装置4中会观察到产生大量白烟,该白烟的化学式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。
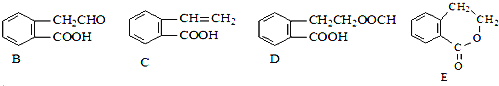
请回答下列问题:
![]() 在
在![]() 五种物质中,互为同分异构体的是______
五种物质中,互为同分异构体的是______![]() 填代号
填代号![]() 。
。
![]() 写出下列反应的反应类型
写出下列反应的反应类型![]() :______,
:______,![]() :______,
:______,![]() :______,
:______,![]() :______。
:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中充入2 mol A和1 mol B发生反应:mA(g) + nB(g) ![]() pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
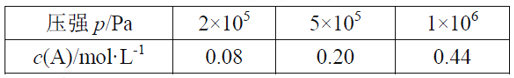
A. 维持压强2×105Pa,若反应开始后5min时达到平衡,则v(A)=0.016mol/(L·min)
B. P从2×105Pa增加到5×105Pa时,平衡逆向移动
C. P为1×106Pa时,平衡常数表达式K=![]()
D. 其它条件相同时,在上述三个压强下分别发生该反应。A的转化率随时间变化曲线如图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能和减排建设友好型社会的必然选择。回答下列问题:
(1)已知在一定温度下,①C(s)+CO2(g) ![]() 2CO(g) ΔH1=a kJ·mol-1 平衡常数K1;
2CO(g) ΔH1=a kJ·mol-1 平衡常数K1;
②CO(g)+H2O(g) ![]() H2(g)+CO2(g) ΔH2=b kJ·mol-1 平衡常数K2。
H2(g)+CO2(g) ΔH2=b kJ·mol-1 平衡常数K2。
某反应的平衡常数表达式K3= ![]() ,请写出此反应的热化学方程式______________,K1、K2、K3之间的关系是_____________。
,请写出此反应的热化学方程式______________,K1、K2、K3之间的关系是_____________。
(2)将原料气按n(CO2)∶n(H2)=1∶4置于密闭容器中发生CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如下图所示:
CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如下图所示:
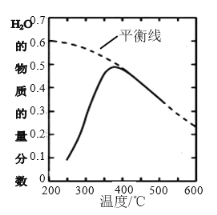
①该反应的平衡常数K随温度降低而________(填“增大”或“减小”)。
②在密闭恒温(高于100℃)恒容装置中进行该反应,达到平衡状态的是________。
a.混合气体密度不再改变 b.混合气体压强不再改变
c.混合气体平均摩尔质量不再改变 d.n(CO2)∶n(H2)=1:2
③200℃达到平衡时体系的总压强为P,该反应平衡常数Kp的计算表达式为______(不必化简,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)500℃时,CO与水反应生成CO2和H2,将其分离得到H2的过程示意图如下:

①阳极反应式是_______________________________________________。
②结合电极反应式,简述K2CO3溶液的再生原理___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为N![]() ,关于反应
,关于反应 下列说法错误的是
下列说法错误的是
A.8.8gCO2中共用电子对的数目为0.8NA
B.消耗CO24.48L(标准状况下)时转移电子的数目为0.8NA
C.12g金刚石(C)中所含共价键的数目为4NA
D.0.1molMgO中所有离子的最外层电子数之和为1.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮废水超标排放是水体富营养化的重要原因,可用以下流程处理:

下列说法正确的是
A.过程I中发生的化学反应属于氧化还原反应
B.过程Ⅱ中![]() ,每转化
,每转化![]() 转移的电子数为6NA
转移的电子数为6NA
C.过程Ⅲ中CH3OH→CO2,甲醇作还原剂
D.过程Ⅲ中HNO3→N2,转移10mol e-时可生成N2 11.2L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从乙醛工业中产生的废钯(Pd)催化剂(钯5-6%,炭93-94%,铁、铜、锌、镍1-2%)中提取PdCl2和CuCl2的工艺流程如图所示:
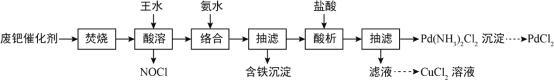
已知:钯、铜、锌、镍可与氨水形成Pd(NH3)42+等络离子。请回答:
(1)“焚烧”的主要目的为______________,实验室中可在______________(填仪器名称)中模拟该过程。
(2)“酸溶”时,Pd转化为PdCl2,其化学方程式为______________;该过程需控温70-80℃,温度不能太低或太高的原因为______________。
(3)“络合”时,溶液的pH需始终维持8-9,则络合后溶液中含铁离子的浓度≦______________。(已知:Fe(OH)2、Fe(OH)3的Ksp甲分别为4×10-17、2.8×10-39)
(4)“酸析”时生成沉淀的离子方程式为______________。
(5)流程中回收得到的PdCl2和CuC12在乙烯直接氧化制乙醛的催化体系中联合发挥作用,反应机理如下:
i.![]() ;
;
ii.______________;
iii.![]() 。
。
ii的化学方程式为______________。
(6)上述提取PdCl2和CuCl2方案的缺点是______________(写出一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液,几个关键实验步骤和操作如图:

(1)现需要94 mL 0.10 mol·L-1 Na2CO3溶液,进行现场配制。上述实验步骤A~F正确的实验次序为_______________________(填字母)。步骤E中将一玻璃仪器上下颠倒数次,写出该仪器的名称_________________。
(2)步骤C通常称为溶解,步骤A通常称为_________。
(3)用Na2CO3·10H2O来配制该溶液,托盘天平称取样品,游码需要打在图示________(填a或b)位置,若称量前晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏_______(填“大”或“小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com