
【题目】氨氮废水超标排放是水体富营养化的重要原因,可用以下流程处理:

下列说法正确的是
A.过程I中发生的化学反应属于氧化还原反应
B.过程Ⅱ中![]() ,每转化
,每转化![]() 转移的电子数为6NA
转移的电子数为6NA
C.过程Ⅲ中CH3OH→CO2,甲醇作还原剂
D.过程Ⅲ中HNO3→N2,转移10mol e-时可生成N2 11.2L(标准状况)
 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。该电池的电解质溶液为KOH溶液,它的充、放电反应按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2,下列叙述中正确的是( )
Cd(OH)2+2Ni(OH)2,下列叙述中正确的是( )
A.放电时,正极反应为Cd-2e-+2OH-=Cd(OH)2
B.充电时,阳极区附近溶液的pH不断变小
C.放电时,每转移0.2mol电子,有0.1mol负极材料被还原
D.充电时,阴极反应为2NiOOH-2e-+2OH-=2Ni(OH)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A.(NH4)2 Fe(SO4)2 溶解于水:(NH4)2 Fe(SO4)2 ![]() 2NH4+ + Fe2 + + 2SO42-
2NH4+ + Fe2 + + 2SO42-
B.Al(OH)3在水中的电离:H+ + H2O+ AlO2-![]() Al(OH)3
Al(OH)3 ![]() Al3 ++3OH-
Al3 ++3OH-
C.H3PO4溶解于水:H3PO4 ![]() 3H+ + PO43-
3H+ + PO43-
D.NaHSO3在水中的电离:HSO3- + H2O ![]() SO32-+ H3O+
SO32-+ H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L恒容密闭容器中充入![]() 、
、![]() ,在一定条件下发生如下反应:
,在一定条件下发生如下反应:![]()
![]() ;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
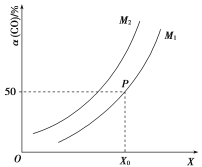
A.工业上,利用上述反应合成甲醇,温度越高越好
B.图象中X代表温度,![]()
C.图象中P点代表的平衡常数K为![]()
D.温度和容积不变,再充入![]() 、1 mol CO,达到平衡时CO的转化率减小
、1 mol CO,达到平衡时CO的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香港城市大学支春义团队研发的Zn/富Co(Ⅲ)Co3O4电池(如图采用ZnSO4和CoSO4为电解质溶液,充放电过程中a极发生CoO与Co3O4之间的转化,从而很好地克服了之前碱性锌一钴电池的缺陷。下列说法错误的是
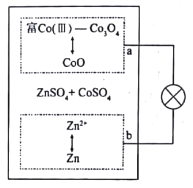
A.放电时,溶液中Co2+浓度不变
B.充电时,溶液中SO42-移向a极
C.充电时,外电路通过2moleˉ,理论上电解质溶液质量减少6g
D.若为碱性介质,会降低电极的可逆性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:2NO2(g)![]() N2O4(g);ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如下图。下列说法中,正确的是
N2O4(g);ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如下图。下列说法中,正确的是

A.反应速率:v正(b点)<v正(d点)
B.前10min内用v(N2O4)表示的平均反应速率为0.04mol/(L·min)
C.25min时,导致平衡移动的原因是升高温度
D.a和c点:Qc(浓度熵)<K(平衡常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列物质 ①NaCl晶体②液态SO2③冰醋酸④硫酸钡⑤铜⑥酒精(C2H5OH)⑦熔化的KCl⑧NaOH溶液⑨氯水⑩纯盐酸,请用以上物质回答下列问题。
属于强电解质且在上述状态下能导电的是____________;属于弱电解质的是_____________; 属于非电解质,但溶于水后的水溶液能导电的是______________。
(2)在密闭容器中,使1 mol N2和3 mol H2混合发生下列反应:N2 (g)+3H2 (g)![]() 2NH3 (g) ΔH <0。
2NH3 (g) ΔH <0。
①达到平衡时, 充入N2并保持体积不变,平衡将______移动(填“正向”、“逆向”或“不”)。
②达到平衡时,充入氩气(Ar)并保持体积不变,平衡将______移动(同上)。
③达到平衡时,充入氩气(Ar),并保持压强不变,平衡将______移动(同上)。
④达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡______移动(同上)。
⑤保持体积不变,升高温度时,混和气体的平均相对分子质量______,密度_______(填“变大”、“变小”或“不变”)。
⑥当反应达到平衡时,N2和H2的浓度比是______;N2和H2的转化率比是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂试剂或操作选用不正确的是( )
物质(括号内为杂质) | 除杂试剂或操作 | |
A | Na2CO3晶体(NaHCO3) | 加热 |
B | CO2(HCl) | 饱和氯化钠溶液、浓H2SO4,洗气 |
C | Fe2O3(SiO2) | NaOH 溶液,过滤 |
D | 稀盐酸(Cl2) | 光照 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。

已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com