
【题目】(1)现有下列物质 ①NaCl晶体②液态SO2③冰醋酸④硫酸钡⑤铜⑥酒精(C2H5OH)⑦熔化的KCl⑧NaOH溶液⑨氯水⑩纯盐酸,请用以上物质回答下列问题。
属于强电解质且在上述状态下能导电的是____________;属于弱电解质的是_____________; 属于非电解质,但溶于水后的水溶液能导电的是______________。
(2)在密闭容器中,使1 mol N2和3 mol H2混合发生下列反应:N2 (g)+3H2 (g)![]() 2NH3 (g) ΔH <0。
2NH3 (g) ΔH <0。
①达到平衡时, 充入N2并保持体积不变,平衡将______移动(填“正向”、“逆向”或“不”)。
②达到平衡时,充入氩气(Ar)并保持体积不变,平衡将______移动(同上)。
③达到平衡时,充入氩气(Ar),并保持压强不变,平衡将______移动(同上)。
④达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡______移动(同上)。
⑤保持体积不变,升高温度时,混和气体的平均相对分子质量______,密度_______(填“变大”、“变小”或“不变”)。
⑥当反应达到平衡时,N2和H2的浓度比是______;N2和H2的转化率比是______。
【答案】⑦ ③ ② 正向 不 逆向 正向 变小 不变 1:3 1:1
【解析】
(1)根据电解质与非电解质及强弱电解质的概念进行判断;溶液中或熔融状态下产生自由移动的离子的化合物,能导电;
(2)根据勒夏特列原理进行判断。
(1)①NaCl晶体其水溶液或熔融状态能导电且为化合物,水溶液能完全电离,为强电解质;
②液态SO2其熔融状态不能导电且为化合物,水溶液中二氧化硫与水反应生成亚硫酸,亚硫酸溶液能导电,为非电解质;
③冰醋酸其水溶液能导电且为化合物,水溶液中部分电离,为弱电解质;
④硫酸钡其熔融状态能导电且为化合物,水溶液能完全电离,为强电解质;
⑤铜属于单质,既不是电解质,也不是非电解质;
⑥酒精(C2H5OH)其水溶液和熔融状态不能导电且为化合物,为非电解质;
⑦熔化的KCl其水溶液或熔融状态能导电且为化合物,水溶液能完全电离,为强电解质;
⑧NaOH溶液为混合物,既不是电解质,也不是非电解质;
⑨氯水为混合物,既不是电解质,也不是非电解质;
⑩纯盐酸为混合物,既不是电解质,也不是非电解质;
强电解质且在上述状态下能导电⑦;属于弱电解质的③;属于非电解质,但溶于水后的水溶液能导电的②;
(2)①达到平衡时,充入N2并保持体积不变,氮气的浓度增大,平衡正向移动;
②达到平衡时,充入氩气(Ar)并保持体积不变,反应体系中各物质的浓度均不变,则平衡不移动
③达到平衡时,充入氩气(Ar),并保持压强不变,反应体系中各物质的浓度均减小,则平衡向物质的量增多的方向移动,即逆向移动;
④将c(N2)、c(H2)、c(NH3)同时增大1倍,相当于增大压强,减小体积,平衡向计量数减小的方向移动,即正反应方向移动;
⑤保持体积不变,正反应为放热反应,升高温度时,平衡逆反应方向移动,气体的总物质的量增大,总质量不变,则平均相对分子质量减小;体积不变,则密度不变;
⑥初始量为1mol、3mol,反应计量数为1:3,则平衡时,剩余量为1:3;N2和H2的转化率相同,为1:1。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是

A. 正极电极反应式为:2H++2e—→H2↑
B. 此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C. 此过程中铜并不被腐蚀
D. 此过程中电子从Fe移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能和减排建设友好型社会的必然选择。回答下列问题:
(1)已知在一定温度下,①C(s)+CO2(g) ![]() 2CO(g) ΔH1=a kJ·mol-1 平衡常数K1;
2CO(g) ΔH1=a kJ·mol-1 平衡常数K1;
②CO(g)+H2O(g) ![]() H2(g)+CO2(g) ΔH2=b kJ·mol-1 平衡常数K2。
H2(g)+CO2(g) ΔH2=b kJ·mol-1 平衡常数K2。
某反应的平衡常数表达式K3= ![]() ,请写出此反应的热化学方程式______________,K1、K2、K3之间的关系是_____________。
,请写出此反应的热化学方程式______________,K1、K2、K3之间的关系是_____________。
(2)将原料气按n(CO2)∶n(H2)=1∶4置于密闭容器中发生CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如下图所示:
CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如下图所示:
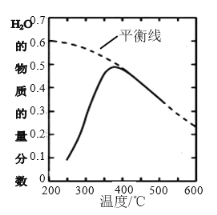
①该反应的平衡常数K随温度降低而________(填“增大”或“减小”)。
②在密闭恒温(高于100℃)恒容装置中进行该反应,达到平衡状态的是________。
a.混合气体密度不再改变 b.混合气体压强不再改变
c.混合气体平均摩尔质量不再改变 d.n(CO2)∶n(H2)=1:2
③200℃达到平衡时体系的总压强为P,该反应平衡常数Kp的计算表达式为______(不必化简,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)500℃时,CO与水反应生成CO2和H2,将其分离得到H2的过程示意图如下:

①阳极反应式是_______________________________________________。
②结合电极反应式,简述K2CO3溶液的再生原理___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮废水超标排放是水体富营养化的重要原因,可用以下流程处理:

下列说法正确的是
A.过程I中发生的化学反应属于氧化还原反应
B.过程Ⅱ中![]() ,每转化
,每转化![]() 转移的电子数为6NA
转移的电子数为6NA
C.过程Ⅲ中CH3OH→CO2,甲醇作还原剂
D.过程Ⅲ中HNO3→N2,转移10mol e-时可生成N2 11.2L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的短周期元素X、Y、Z、W、M可形成a、b两种化合物(如图),a为磁共振氢谱中常用的参照物,b为有机合成中的一种还原剂。下列说法错误的是
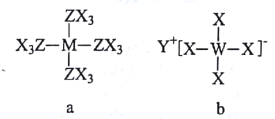
A.原子半径:W>M>Z
B.元素非金属性:Z>M
C.W的最高价氧化物的水化物具有两性
D.常温常压下X与Z形成的化合物为气态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从乙醛工业中产生的废钯(Pd)催化剂(钯5-6%,炭93-94%,铁、铜、锌、镍1-2%)中提取PdCl2和CuCl2的工艺流程如图所示:
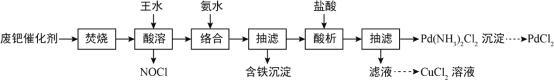
已知:钯、铜、锌、镍可与氨水形成Pd(NH3)42+等络离子。请回答:
(1)“焚烧”的主要目的为______________,实验室中可在______________(填仪器名称)中模拟该过程。
(2)“酸溶”时,Pd转化为PdCl2,其化学方程式为______________;该过程需控温70-80℃,温度不能太低或太高的原因为______________。
(3)“络合”时,溶液的pH需始终维持8-9,则络合后溶液中含铁离子的浓度≦______________。(已知:Fe(OH)2、Fe(OH)3的Ksp甲分别为4×10-17、2.8×10-39)
(4)“酸析”时生成沉淀的离子方程式为______________。
(5)流程中回收得到的PdCl2和CuC12在乙烯直接氧化制乙醛的催化体系中联合发挥作用,反应机理如下:
i.![]() ;
;
ii.______________;
iii.![]() 。
。
ii的化学方程式为______________。
(6)上述提取PdCl2和CuCl2方案的缺点是______________(写出一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容密闭容器中,可逆反应2NO2(g)![]() 2NO(g)+ O2(g)达到平衡状态的标志是
2NO(g)+ O2(g)达到平衡状态的标志是
①2V(O2)=V(NO2)
②单位时间内生成n molO2的同时生成2n molNO2
③NO2、NO、O2的浓度之比为2∶2∶1
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变
A.②④⑥ B.①④⑥ C.②④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期的A、B、C、D、E五种元素,原子序数逐渐增大。A元素核外有三个电子层,最外层电子数是核外电子总数的1/6;B元素核外只有一个未成对电子,能与水剧烈反应;C元素正三价离子的3d轨道为半充满状态;D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;E元素的价电子构型为nsanpa+1,其某种氧化物有剧毒。
(1)A元素的第一电离能___Al元素的第一电离能(填“<”“>”或“=”),请解释原因___。
(2)写出B2O2与H2O反应过程中断裂的化学键的种类___。
(3)C元素位于元素周期表的___区,它的价电子排布式是___,C(CO)x的中心原子价电子数与配位数提供的电子数之和为18,则x=___。
(4)D2O的熔点比D2S的熔点高,其原因是___。
(5)ECl3分子的立体构型为___,其中E的杂化类型为___,E元素可能的性质为___(从下列选项中选择)。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
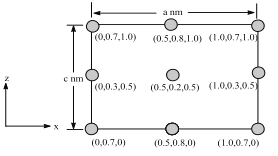
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。BSiAl3O7属于正交晶系(长方体形),晶胞参数为anm、bnm、cnm。如图为沿y轴投影的晶胞中所有B原子的分布图和原子分数坐标。据此推断该晶胞中B原子数目为___;BSiAl3O7的摩尔质量为Mgmol-1,设NA为阿伏伽德罗常数的值,则晶体的密度=___(gcm3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在C(s)+CO2(g)![]() 2CO(g)反应中,可使反应速率增大的措施是
2CO(g)反应中,可使反应速率增大的措施是
①压缩容器体积 ②增加炭的量 ③恒容下通入CO2 ④恒压下充入N2 ⑤恒容下充入N2 ⑥升高温度
A.①③⑥B.②④⑥C.①③④D.③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com