
【题目】原子序数依次增大的短周期元素X、Y、Z、W、M可形成a、b两种化合物(如图),a为磁共振氢谱中常用的参照物,b为有机合成中的一种还原剂。下列说法错误的是
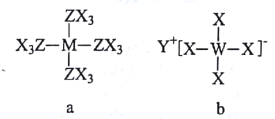
A.原子半径:W>M>Z
B.元素非金属性:Z>M
C.W的最高价氧化物的水化物具有两性
D.常温常压下X与Z形成的化合物为气态
【答案】D
【解析】
a为磁共振氢谱中常用的参照物,根据a的结构推测a为四甲基硅,M为Si元素、Z为C元素、X为H元素,b为有机合成中的一种还原剂,b应为四氢铝锂,W为Al元素,Y为Li元素,符合原子序数依次增大的短周期元素这一要求。
A. 核外电子层数越多,原子半径越大,电子层数相同时,核电荷数越大,原子半径越小,所以原子半径W>M>Z,A正确;
B. 同主族元素,从上到下,非金属性逐渐减弱,所以C元素的非金属性强于Si,B正确;
C. W的最高价氧化物的水化物为![]() ,
,![]() 为两性氢氧化物,C正确;
为两性氢氧化物,C正确;
D. X与Z形成的化合物为烃,当烃的相对分子量较大时,常温常压下可以为液态和固态,D错误;
故答案选D。


科目:高中化学 来源: 题型:
【题目】黄铁矿(FeS2)催化氧化的化学方程式为:2FeS2+7O2+2H2O 2FeSO4+2H2SO4。已知NA是阿伏加德罗常数的值,下列说法正确的是
2FeSO4+2H2SO4。已知NA是阿伏加德罗常数的值,下列说法正确的是
A.FeSO4和H2SO4都是离子化合物,均属于强电解质
B.0.1 mol·L-1 FeSO4 溶液中Fe2+离子的浓度为0.1 mol·L-1
C.FeSO4既是被氧化得到的产物,又是被还原得到的产物
D.当转移2 mol电子时,消耗氧气的体积(标准状况)约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述违背化学原理的是
A.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
B.反应A(g)+3B(g)![]() 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大
2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大
C.SO2的催化氧化是一个放热的反应,升高温度,反应速率加快
D.多元弱酸各步电离常数相互关系为K1![]() K2
K2![]() K3
K3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香港城市大学支春义团队研发的Zn/富Co(Ⅲ)Co3O4电池(如图采用ZnSO4和CoSO4为电解质溶液,充放电过程中a极发生CoO与Co3O4之间的转化,从而很好地克服了之前碱性锌一钴电池的缺陷。下列说法错误的是
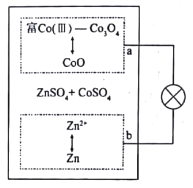
A.放电时,溶液中Co2+浓度不变
B.充电时,溶液中SO42-移向a极
C.充电时,外电路通过2moleˉ,理论上电解质溶液质量减少6g
D.若为碱性介质,会降低电极的可逆性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
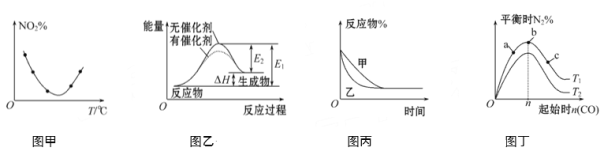
A. 图甲表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
B. 图乙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变
C. 图丙表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,则P乙>P甲
3C(g)+D(g)的影响,则P乙>P甲
D. 图丁表示反应:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列物质 ①NaCl晶体②液态SO2③冰醋酸④硫酸钡⑤铜⑥酒精(C2H5OH)⑦熔化的KCl⑧NaOH溶液⑨氯水⑩纯盐酸,请用以上物质回答下列问题。
属于强电解质且在上述状态下能导电的是____________;属于弱电解质的是_____________; 属于非电解质,但溶于水后的水溶液能导电的是______________。
(2)在密闭容器中,使1 mol N2和3 mol H2混合发生下列反应:N2 (g)+3H2 (g)![]() 2NH3 (g) ΔH <0。
2NH3 (g) ΔH <0。
①达到平衡时, 充入N2并保持体积不变,平衡将______移动(填“正向”、“逆向”或“不”)。
②达到平衡时,充入氩气(Ar)并保持体积不变,平衡将______移动(同上)。
③达到平衡时,充入氩气(Ar),并保持压强不变,平衡将______移动(同上)。
④达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡______移动(同上)。
⑤保持体积不变,升高温度时,混和气体的平均相对分子质量______,密度_______(填“变大”、“变小”或“不变”)。
⑥当反应达到平衡时,N2和H2的浓度比是______;N2和H2的转化率比是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和五氧化二钒在工业应用中广泛,某工厂从钒渣中回收金属,钒渣中主要成分有V2O3、FeO,还含有少量的CuO、Al2O3,工艺流程如图:
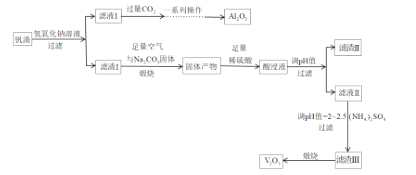
已知:①KspCu(OH)2=1.0×1021;KspFe(OH)3=4.0×1038;KspFe(OH)2=8.0×1016。
②NH4VO3难溶于水,(VO2)2SO4易溶于水。
(1)写出滤液I中加入过量的CO2时发生反应的离子方程式;制取纯净的Al2O3需要经过一系列操作:过滤、___、___。
(2)煅烧时,滤渣I的主要成分V2O3转化为可溶性NaVO3,写出其反应的化学方程式___。
(3)加入稀硫酸后,酸浸液中VO3与VO2+能大量共存的原因是___(用离子方程式解释)。
(4)常温下调节酸浸液的pH=___,即可以完全除去铁、铜两种元素对应的离子___;实际pH值要调整到8,其目的是___;调pH=2~2.5后过滤,滤渣III的主要成分为___。
(5)请写出煅烧滤渣III时,发生反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列说法正确的是( )
A.将pH=2的盐酸和pH=4的硫酸等体积混合,所得溶液pH=3
B.HF比HCN易电离,则HF溶液的导电能力比HCN溶液的大
C.向0.1mol/L氨水中加入少量硫酸铵固体,溶液中![]() 增大
增大
D.将1mLpH=3的HA溶液稀释到10mL,若溶液的pH<4,则HA为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5L某浓度的NaCl溶液中含有0.5molNa+,下列对该溶液的说法中,正确的是( )
A.该溶液中含有58.5gNaCl
B.配制100mL该溶液需用托盘天平称取5.85gNaCl
C.量取100mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1mol
D.将0.5molNaCl溶于0.5L水中可得到该溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com