
【题目】下列描述违背化学原理的是
A.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
B.反应A(g)+3B(g)![]() 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大
2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大
C.SO2的催化氧化是一个放热的反应,升高温度,反应速率加快
D.多元弱酸各步电离常数相互关系为K1![]() K2
K2![]() K3
K3
科目:高中化学 来源: 题型:
【题目】已知某粗盐样品中含有Na2SO4、MgCl2、CaCl2等杂质.实验室提纯流程如下:
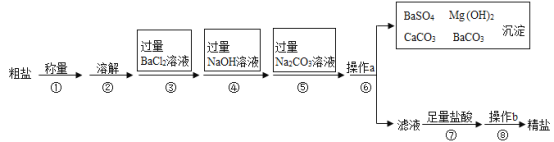
(1)用托盘天平称量粗盐时,若砝码和粗盐位置放颠倒,天平平衡时,读数为5.4g,实际称得粗盐的质量是__________。
A.5.4g B.4.6g C.6.0g D.5.0g
(2)第③步操作发生反应的化学方程式是__________________________
(3)第④步操作发生反应的化学方程式是_______________________
(4)第⑤步操作的目的是 ___________________________
(5)第⑥步操作a的名称是 ________,此步操作中,玻璃棒的末端要轻轻地斜靠在 _____________的一边。
(6)第⑦步操作中,向滤液中滴加足量盐酸的目的是_____________,此步操作中产生气泡的化学方程式是___________________。
(7)在第⑧步操作时,要用玻璃棒不断搅拌,目的是_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气态亚硝酸(HNO2或HONO)是大气中的一种污染物。
(1)亚硝酸的电离平衡常数Ka=6.0×10﹣6,其电离方程式为________。
(2)亚硝酸分子中各原子最外层电子均达到稳定结构,其电子式为________。
(3)亚硝酸进入人体可以与二甲胺[(CH3)2NH]迅速反应生成亚硝酸胺[CH3)2N-N=O],亚硝酸胺是最重要的化学致癌物之一。
① 亚硝酸与二甲胺反应生成亚硝酸胺的一种反应机理如下:
HONO+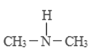
![]()
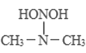
![]()
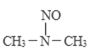
过程ⅰ和过程ⅱ的反应类型分别为:________、消去反应。
② 上述反应机理的反应过程与能量变化的关系如图:
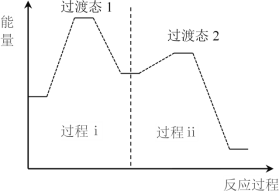
亚硝酸与二甲胺反应生成亚硝酸胺的反应ΔH________0(填“>”或“<”)。反应难度更大的是过程________(填“ⅰ”或“ⅱ”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.NO2和N2O4平衡混合气缩小体积加压后颜色先变深后变浅一点
C.高锰酸钾溶液与草酸发生化学反应刚开始缓慢,随后反应迅速加快
D.硫酸工业上SO2氧化成SO3,通入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的锌碘单液流电池,其原理如下图所示。下列说法不正确的是 ( )。
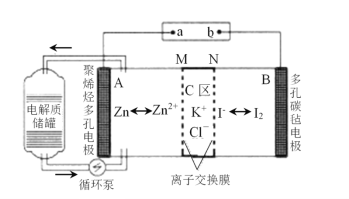
A.放电时B电极反应式为:I2+2e-=2I-
B.M为阳离子交换膜,N为阴离子交换膜
C.充电时,A极增重65g时,C区增加离子数为4NA
D.放电时电解质储罐中离子总浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能和减排建设友好型社会的必然选择。回答下列问题:
(1)已知在一定温度下,①C(s)+CO2(g) ![]() 2CO(g) ΔH1=a kJ·mol-1 平衡常数K1;
2CO(g) ΔH1=a kJ·mol-1 平衡常数K1;
②CO(g)+H2O(g) ![]() H2(g)+CO2(g) ΔH2=b kJ·mol-1 平衡常数K2。
H2(g)+CO2(g) ΔH2=b kJ·mol-1 平衡常数K2。
某反应的平衡常数表达式K3= ![]() ,请写出此反应的热化学方程式______________,K1、K2、K3之间的关系是_____________。
,请写出此反应的热化学方程式______________,K1、K2、K3之间的关系是_____________。
(2)将原料气按n(CO2)∶n(H2)=1∶4置于密闭容器中发生CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如下图所示:
CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如下图所示:
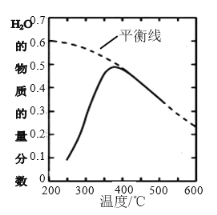
①该反应的平衡常数K随温度降低而________(填“增大”或“减小”)。
②在密闭恒温(高于100℃)恒容装置中进行该反应,达到平衡状态的是________。
a.混合气体密度不再改变 b.混合气体压强不再改变
c.混合气体平均摩尔质量不再改变 d.n(CO2)∶n(H2)=1:2
③200℃达到平衡时体系的总压强为P,该反应平衡常数Kp的计算表达式为______(不必化简,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)500℃时,CO与水反应生成CO2和H2,将其分离得到H2的过程示意图如下:

①阳极反应式是_______________________________________________。
②结合电极反应式,简述K2CO3溶液的再生原理___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是元素周期表中前18号某种金属元素对应的单质及其化合物之间的转化关系(“→”所指的转化都是一步完成)。
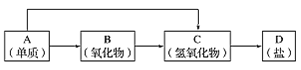
(1)若B为呼吸面具中的供氧剂,其供氧时每生成1molO2,反应过程中转移的电子数为_____,A与FeCl3溶液反应的离子方程式________________________。
(2)写出一个“C→D”转化的化学方程式_________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的短周期元素X、Y、Z、W、M可形成a、b两种化合物(如图),a为磁共振氢谱中常用的参照物,b为有机合成中的一种还原剂。下列说法错误的是
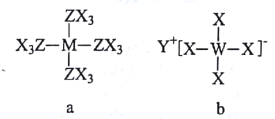
A.原子半径:W>M>Z
B.元素非金属性:Z>M
C.W的最高价氧化物的水化物具有两性
D.常温常压下X与Z形成的化合物为气态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)
A. 11.52 B. 11.70
C. 11.82 D. 12.00
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com