
【题目】一种新型的锌碘单液流电池,其原理如下图所示。下列说法不正确的是 ( )。
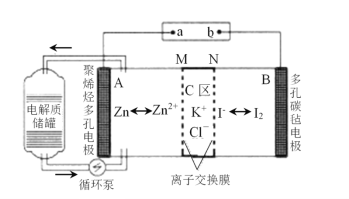
A.放电时B电极反应式为:I2+2e-=2I-
B.M为阳离子交换膜,N为阴离子交换膜
C.充电时,A极增重65g时,C区增加离子数为4NA
D.放电时电解质储罐中离子总浓度增大
【答案】B
【解析】
由装置图可知,放电时,Zn是负极,负极反应式为Zn-2e-═Zn2+,石墨是正极,反应式为I2+2e-=2I-,外电路中电流由正极经过导线流向负极,充电时,阳极反应式为2I--2e-=I2、阴极反应式为Zn2++2e-=Zn,据此分析解答。
A.放电时,B电极为正极,I2得到电子生成I-,电极反应式为I2+2e-=2I-,故A正确;
B.离子交换膜是防止正负极I2、Zn接触直接发生氧化还原反应,负极区生成Zn2+、正电荷增加,正极区生成I-、负电荷增加,所以Cl-通过M膜进入负极,K+通过N膜进入正极,所以M为阴离子交换膜,N为阳离子交换膜,故B错误;
C.充电时,A极反应式Zn2++2e-=Zn,A极增重65g转移2mol电子,所以C区增加2molK+、2molCl-,离子总数为4NA,故C正确;
D.放电时,Zn是负极,负极反应式为Zn-2e-═Zn2+,石墨是正极,反应式为I2+2e-=2I-,转移2mol电子时负极生成1mol的锌离子,正极产生2mol的碘离子,所以放电时电解质储罐中离子总浓度增大,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】石油炼制过程中产生的H2S是一种有毒气体,其有效利用是亟需解决的问题。
(1)H2S的电子式是_________。
(2)热分解法处理H2S
H2S(g)=H2(g)+S(s) ΔH1
已知:i.2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH2
ii.S(s)+O2(g)=SO2(g) ΔH3
①利用ΔH2和ΔH3计算ΔH1时,还需要利用_______反应的ΔH。
②直接加热分解H2S转化率低,科学家发现MoS2可以催化H2S分解制取氢气和硫磺,多孔陶瓷膜可以使氢气选择性分离。科学家使用沉积有MoS2的多孔陶瓷膜装置进行反应的原因有_________。
(3)电化学法处理H2S
为避免硫磺沉积在阳极,将氧化吸收和电解制氢过程分开进行,装置如图所示。氧化吸收器中为Fe2(SO4)3溶液,电解反应器中,以石墨为阳极,以Pt为阴极,中间用质子交换膜隔开。
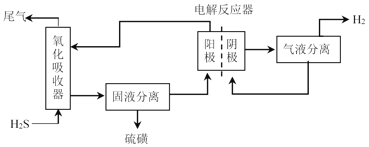
①氧化吸收器中反应的离子方程式为_________。
②电解反应器中,阴极的电极反应式为_________。
③电解反应器的作用是_________(写出2点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

Ⅰ.若X、Y是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞。
(1)写出电解饱和食盐水的离子方程式____;
(2)在X极附近观察到的现象是____。
Ⅱ.若用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
(1)X电极电极反应式是____,Y电极的材料是___;
(2)当电路中有0.04mol电子通过时,阴极增重___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A.焊接铁轨: 2Fe + Al2O3![]() 2Al + Fe2O3
2Al + Fe2O3
B.工业固氮: N2 + 3H2![]() 2NH3
2NH3
C.用纯碱除油污:CO32-+H2O![]() HCO3-+ OH-
HCO3-+ OH-
D.用湿润的淀粉KI试纸检验Cl2:Cl2 + 2I-=2Cl-+I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照物质的树状分类和交叉分类,硫酸应属于____________
①酸 ②化合物③含氧酸④电解质⑤能导电的纯净物⑥二元酸⑦混合物
A.①③④⑤⑥ B.①②③④⑥ C.①②③⑤⑥⑦D.②③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述违背化学原理的是
A.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
B.反应A(g)+3B(g)![]() 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大
2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大
C.SO2的催化氧化是一个放热的反应,升高温度,反应速率加快
D.多元弱酸各步电离常数相互关系为K1![]() K2
K2![]() K3
K3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题。
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧CO2
(1)写出Na2O2的电子式________,存在的化学键类型有________________。
(2)写出HClO电子式________________,写出CO2的结构式_______。
(3)含有共价键的离子化合物是_______(填序号)
(4)用电子式表示CaBr2的形成过程_________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
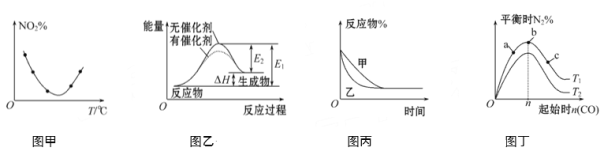
A. 图甲表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
B. 图乙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变
C. 图丙表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,则P乙>P甲
3C(g)+D(g)的影响,则P乙>P甲
D. 图丁表示反应:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物F是有机化工的重要原料,也可制毒,受公安部管制。
已知:苯环上有烷烃基时,新引入的取代基连在烷烃基的邻对位上;苯环上有羧基时,新引入的取代基连在羧基的间位上。
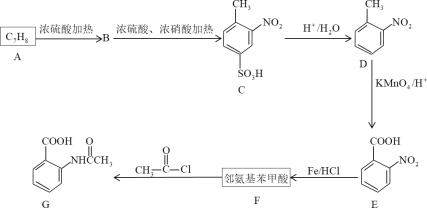
(1)D物质的名称为___,G中官能团的名称为___、___。
(2)A、F的结构简式分别为___、___,E生成F的反应类型是___。
(3)写出A→B产生较多的副产物的结构简式___,该流程未采用甲苯直接硝化的方法制取D,而是经历几步反应才制得D的目的是___。
(4)F在一定条件下能发生聚合反应,请写出其化学反应方程式___。
(5)F的同分异构体中,氨基直接连在苯环上、且能发生银镜反应的芳香族化合物共有___种(不含立体结构)。
(6)请以甲苯为原料,写出合成间氨基苯甲酸的流程图___(无机试剂任选)。合成流程图表示方法示例:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com