
����Ŀ����ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ��������ش��������⣺

��.��X��Y�Ƕ��Ե缫��a�DZ���NaCl��Һ��ʵ�鿪ʼʱ��ͬʱ�����߸����뼸�η�̪��
��1��д����ⱥ��ʳ��ˮ�����ӷ���ʽ____��
��2����X�������۲쵽��������____��
�����õ�ⷽ��������ͭ�����Һaѡ��CuSO4��Һ����
��1��X�缫�缫��Ӧʽ��____��Y�缫�IJ�����___��
��2������·����0.04mol����ͨ��ʱ����������___g��
���𰸡�2Cl����2H2O![]() Cl2����H2����2OH�� �����ݲ�������Һ���ɫ Cu2����2e����Cu ��ͭ 1.28
Cl2����H2����2OH�� �����ݲ�������Һ���ɫ Cu2����2e����Cu ��ͭ 1.28
��������
��1����ⱥ��ʳ��ˮ�����������ơ���������������ⷴӦ�����ӷ���ʽΪ2Cl����2H2O![]() Cl2����H2����2OH����
Cl2����H2����2OH����
��2����X�������۲쵽�������������ݲ�������Һ���ɫ��
��ͭ�ᴿʱ����ͭӦ����������ͭ������������ͭ��Һ�����Һ��
��1��Y��������X������������X�缫�缫��ӦʽΪCu2����2e����Cu��Y�缫�IJ����Ǵ�ͭ��
��2��������ӦʽΪCu2����2e����Cu���ʵ���·����0.04mol����ͨ��ʱ����������0.04mol ��![]() ��64g/mol=1.28g��
��64g/mol=1.28g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯��������ԭ��Ӧ�ص��ǣ� ��
A.��FeCl3��Һ�еμ�KSCN��Һ����Һ���
B.������Ͷ��ˮ�У����������
C.��ʢ���������Թܵ�����ˮ�У�ˮλ����
D.��H2S��Һ��ͨ��SO2���壬��������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���к��ȵIJⶨʵ������ͼ����
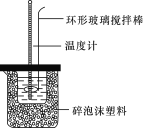
��1����ȡ��Ӧ��ʱ��ȡ50 mL 0.50 mol��L��1�����ᣬ��Ӧ������Լ���________�����������
A��50mL0.50mol��L��1NaOH��Һ
B��50mL0.55mol��L��1NaOH��Һ
C��1.0gNaOH����
��2����ʵ������У���ͬѧ��Ҫ�ⶨ����¼��ʵ��������_____________�����������
A�������Ũ��
B��������¶�
C������������Һ��Ũ��
D������������Һ���¶�
E��ˮ�ı�����
F����Һ��Ϻ������¶�
��3������50 mL 0.5 mol��L��1������Һ������������ⶨ�к��ȣ���������_____________������ƫ��������ƫС����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����[Ce2(CO3)3]���Ʊ�ϡ��������ϡ�����β��������������Ҫԭ�ϡ�̼�����������Ȼ����̼����立�Ӧ�Ʊ�����ͬѧ��������װ��ģ���Ʊ�Ce2(CO3)3��
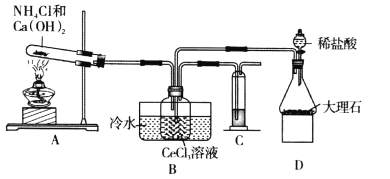
��֪��i.װ��C����ҺΪ����������Һ��
ii.Ksp[Ce2(CO3)3]=1.00��10-28��
iii.Ce3+�ױ�����������Ce4+��
(1)װ��D��ʢ��ϡ�����ʵ����������Ϊ________��װ��C����Һ��������________��
(2)װ��A�з����Ļ�ѧ��Ӧ����ʽΪ________��
(3)ʵ��װ������һ��������������Բ�����֮��д���Ľ���ʩ��________��
(4)װ��B���Ʊ�Ce2(CO3)3��Ӧ�����ӷ���ʽΪ________��
(5)ʵ������е�Ce3+������ȫʱ![]() ����Һ��
����Һ��![]() Ϊ________��
Ϊ________��
(6)Ce2(CO3)3��װ��B�г�����Ȼ�����á����ˡ�ϴ�ӡ�����ɵõ���Ʒ�������Ʒ�Ƿ�ϴ�Ӹɾ��ķ���Ϊ________��
(7)Ϊ�ⶨ��Ʒ��Ce2(CO3)3�Ĵ��ȣ�ȡ![]() ��Ʒ����ϡ���ᡢ
��Ʒ����ϡ���ᡢ![]() ��Һ��ȫ���ܽ⣬���
��Һ��ȫ���ܽ⣬���![]() ��Һ��ȡ
��Һ��ȡ![]() ��Һ��
��Һ��![]() ��
��![]() ��Һ�ζ����յ�(�汻��ԭ��Ce3+)������
��Һ�ζ����յ�(�汻��ԭ��Ce3+)������![]() ��Һ
��Һ![]() �����Ʒ��Ce2(CO3)3�Ĵ���Ϊ________��
�����Ʒ��Ce2(CO3)3�Ĵ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ��ԭ�Ϻͻ����Լ���������״��ϳɼ��Ĵ��������¡�����˵��������ȷ����
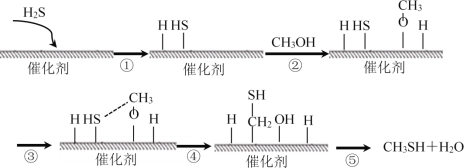
A.CH3SH��̼Ԫ�ػ��ϼ�Ϊ��2��
B.���̢��У��γ���O��H����C��H��
C.�ô�������Ч��߷�Ӧ���ƽ��ת����
D.������״��ϳɼ��ķ�Ӧ����Ϊȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̬������(HNO2��HONO)�Ǵ����е�һ����Ⱦ�
(1)������ĵ���ƽ�ⳣ��Ka��6.0��10��6������뷽��ʽΪ________��
(2)����������и�ԭ���������Ӿ��ﵽ�ȶ��ṹ�������ʽΪ________��
(3)��������������������װ�[(CH3)2NH]Ѹ�ٷ�Ӧ���������᰷[CH3)2N��N��O]�������᰷������Ҫ�Ļ�ѧ�°���֮һ��
�� ����������װ���Ӧ���������᰷��һ�ַ�Ӧ�������£�
HONO+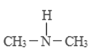
![]()
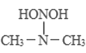
![]()
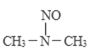
���̢����̢��ķ�Ӧ���ͷֱ�Ϊ��________����ȥ��Ӧ��
�� ������Ӧ�����ķ�Ӧ�����������仯�Ĺ�ϵ��ͼ��
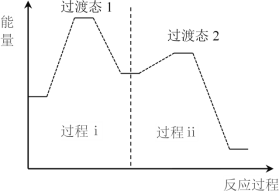
����������װ���Ӧ���������᰷�ķ�Ӧ��H________0(����������������)����Ӧ�Ѷȸ�����ǹ���________(����������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�װ��ͼ�������У���ȷ����
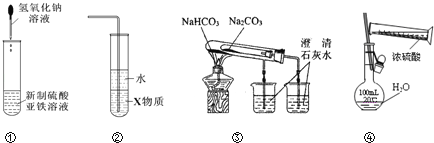
A.����װ�âٿ��Ʊ���������������ʱ��۲�����ɫ
B.װ�â���X��Ϊ���Ȼ�̼������������HCl���壬����ֹ����
C.װ�â���֤Na2CO3��NaHCO3���ֹ�������ȶ���
D.ͨ���ܵķ�������һ��Ũ�ȵ�ϡ������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����͵�п�ⵥҺ����أ���ԭ������ͼ��ʾ������˵������ȷ���� (����)��
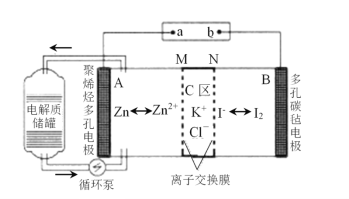
A.�ŵ�ʱB�缫��ӦʽΪ��I2+2e-=2I-
B.MΪ�����ӽ���Ĥ��NΪ�����ӽ���Ĥ
C.���ʱ��A������65gʱ��C������������Ϊ4NA
D.�ŵ�ʱ����ʴ�����������Ũ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧС������֤��Ӧ��![]() ����ʵ���м�Fe3+�����ֺ�̽���������£�
����ʵ���м�Fe3+�����ֺ�̽���������£�
�������ữ��0.05mol��L-1��������Һ(pH��2)�м���������ۣ�����Ƭ�̣��ձ��ײ��к�ɫ���壬��Һ�ʻ�ɫ��
(1)̽����Ӧ����
��ȡ�ϲ���Һ���������Ը��������Һ�У���Һ��ɫ��ȥ��˵����Һ�к��е�������________(д��ѧʽ)��
��ȡ������ɫ���壬ϴ�Ӻ�ϡ�����ܽ���壬�ټ����ᣬ�۲쵽________��֤����ɫ�����к���Ag��
(2)�ԡ���Һ�ʻ�ɫ������̽��
�ټ���Ϊ��Һ����Fe3+������Ϊ���۹���ʱ��������Fe3+���ҵ�������________(�����ӷ���ʽ��ʾ)��
�ڶ�Fe3+������ԭ���������¼��裺
��������е�O2��Fe2+������
�����������Һ��![]() ���������ԣ���Fe2+������
���������ԣ���Fe2+������
�������Һ�е�________��Fe2+������
��ʵ����֤��
�����������ữ��NaNO3��Һ(pH��2)�м���������ۣ�������ã�ȡ��ͬʱ����ϲ���Һ�μ�KSCN��Һ��3minʱ��Һ��dz��ɫ��30min����Һ������ɫ��
�������������ϲ���Һ�м���________��Һ���к�ɫ�������������ϲ���Һ�еμ�KSCN��Һ����Һ��졣
���ۺ�����ʵ���֪������________(�����)��ȷ������Fe2+�����ӷ���ʽ��________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com