
【题目】已知某粗盐样品中含有Na2SO4、MgCl2、CaCl2等杂质.实验室提纯流程如下:
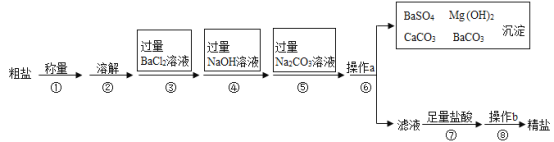
(1)用托盘天平称量粗盐时,若砝码和粗盐位置放颠倒,天平平衡时,读数为5.4g,实际称得粗盐的质量是__________。
A.5.4g B.4.6g C.6.0g D.5.0g
(2)第③步操作发生反应的化学方程式是__________________________
(3)第④步操作发生反应的化学方程式是_______________________
(4)第⑤步操作的目的是 ___________________________
(5)第⑥步操作a的名称是 ________,此步操作中,玻璃棒的末端要轻轻地斜靠在 _____________的一边。
(6)第⑦步操作中,向滤液中滴加足量盐酸的目的是_____________,此步操作中产生气泡的化学方程式是___________________。
(7)在第⑧步操作时,要用玻璃棒不断搅拌,目的是_______________________
【答案】B BaCl2+Na2SO4 =BaSO4↓+2NaCl MgCl2+2NaOH=Mg(OH)2↓+ 2NaCl 除尽Ca2+和过量的Ba2+ 过滤 三层滤纸 除尽过量的OH-和CO32- Na2CO3+2HCl=2NaCl+H2O+CO2 防止局部温度过高使液体飞溅
【解析】
(1)根据左盘总质量=右盘总质量+游码读数;
(2)第③步滴加BaCl2溶液,与Na2SO4作用生成BaSO4沉淀;
(3) 根据加入过量氢氧化钠溶液的目的是除去氯化镁进行解答;
(4)第⑤步操作滴加过量Na2CO3溶液后有CaCO3和BaCO3沉淀生成;
(5)第⑥步操作的目的是固液分离;
(6)根据在第⑦步操作中,向滤液中滴加足量盐酸的目的是除去加入的过量试剂NaOH和Na2CO3进行解答;
(7) 根据蒸发结晶过程中玻璃棒的作用进行解答。
(1) 砝码和粗盐位置放颠倒,天平平衡时,读数为5.4g,则砝码是5g、游码读数是0.4g,根据左盘总质量=右盘总质量+游码读数,可知粗盐的质量=5g-0.4g=4.6g,故答案为B;
(2) 第③步滴加BaCl2溶液,与Na2SO4作用生成BaSO4沉淀,发生反应的化学方程式是BaCl2+Na2SO4 =BaSO4↓+2NaCl;
(3) 第④步操作中加入过量氢氧化钠溶液的目的是除去氯化镁,发生反应的化学方程式是MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
(4) 第⑤步操作加入过量的碳酸钠溶液,能除去氯化钙和过量的氯化钡,故其目的是除去氯化钙和过量的氯化钡;
(5) 过滤用于分离难溶性固体和可溶性固体的方法,第⑥步操作a的名称是过滤,此步操作中,玻璃棒的末端要轻轻地斜靠在三层滤纸的一边;
(6) 在第⑦步操作中,向滤液中滴加足量盐酸的目的是除去加入的过量试剂NaOH和Na2CO3,其中与Na2CO3反应时的方程式为Na2CO3+2HCl=2NaCl+H2O+CO2;
(7) 蒸发结晶过程中玻璃棒的作用:防止蒸发时因局部温度过高,造成液滴飞溅。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】T℃时,向2.0L恒容密闭容器中充入0.80molA,发生反应:![]()
![]() ,经一段时间后达到平衡。反应过程中测定的部分数据见表:
,经一段时间后达到平衡。反应过程中测定的部分数据见表:
时间/min | 0 | 10 | 20 | 30 | 40 |
| 0.80 | 0.60 | 0.48 |
|
|
| 0.00 | 0.20 |
| 0.40 | 0.40 |
下列说法不正确的是
A.该反应在30min时已达到平衡
B.反应在前20min的平均速率为![]()
C.保持其他条件不变,升高温度,平衡时,![]() ,则
,则![]()
D.相同温度下,起始时向容器中充入0.10molA、0.10molB和0.30molC,达到平衡前的反应速率:v逆>v正
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法不正确的是( )
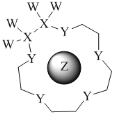
A.Y单质的氧化性在同主族中最强
B.离子半径:Z>Y
C.Z与Y可组成多种离子化合物
D.氢化物的热稳定性:Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向两只分别盛有50 mL0.100 mol/L盐酸的烧杯中各自匀速滴加50 mL蒸馏水、50 mL0.100 mol/L醋酸铵溶液,装置如图所示(夹持仪器等已略)。
已知:常温下,CH3COONH4溶液pH约为7。
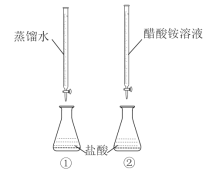
下列说法正确的是( )
A.实验①滴加过程中溶液所有离子浓度都减小
B.实验②滴至pH=2时,溶液中c(Cl-)+c(CH3COO-)+c(OH-)=0.01 mol/L
C.实验②滴加过程中,溶液中均存在c(CH3COO-)<c(NH4+)
D.滴定结束后,①中水的电离程度比②中大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油炼制过程中产生的H2S是一种有毒气体,其有效利用是亟需解决的问题。
(1)H2S的电子式是_________。
(2)热分解法处理H2S
H2S(g)=H2(g)+S(s) ΔH1
已知:i.2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH2
ii.S(s)+O2(g)=SO2(g) ΔH3
①利用ΔH2和ΔH3计算ΔH1时,还需要利用_______反应的ΔH。
②直接加热分解H2S转化率低,科学家发现MoS2可以催化H2S分解制取氢气和硫磺,多孔陶瓷膜可以使氢气选择性分离。科学家使用沉积有MoS2的多孔陶瓷膜装置进行反应的原因有_________。
(3)电化学法处理H2S
为避免硫磺沉积在阳极,将氧化吸收和电解制氢过程分开进行,装置如图所示。氧化吸收器中为Fe2(SO4)3溶液,电解反应器中,以石墨为阳极,以Pt为阴极,中间用质子交换膜隔开。
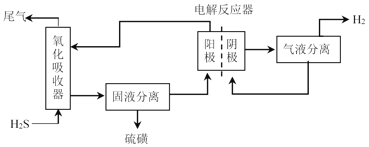
①氧化吸收器中反应的离子方程式为_________。
②电解反应器中,阴极的电极反应式为_________。
③电解反应器的作用是_________(写出2点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于自然界中氮循环(如图)的说法不正确的是:

A. 氮元素均被氧化
B. 工业合成氨属于人工固氮
C. 含氮无机物和含氮有机物可相互转化
D. 碳、氢、氧三种元素也参与了氮循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+与SO32-不能大量共存的原因是存在氧化还原反应和双水解反应之争。如图是利用手持技术测量向FeCl3溶液滴加Na2SO3溶液过程中的pH和电导率的变化情况:
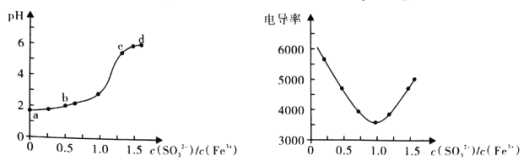
实验过程还发现:
i.b点时溶液澄清透明,向其中分别加入KSCN溶液和NaOH溶液,现象分别为出现血红色和灰绿色难溶物;
ii.c点和d点均出现明显红褐色难溶物,取上层清液,分别加入KSCN溶液和NaOH溶液,现象分别为出现血红色和无明显变化。
结合以上信息,下列分析不合理的是
A.a点溶液在配置时需加入盐酸
B.结合b点附近pH的变化以及实验现象,说明此处发生了氧化还原反应
C.c点溶液中发生的主要反应为2Fe3++3SO32-+6H2O=2Fe(OH)3↓+3H2SO3
D.取d点处上层清液,向其中滴加K3[Fe(CN)6],溶液会出现蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿(FeS2)催化氧化的化学方程式为:2FeS2+7O2+2H2O 2FeSO4+2H2SO4。已知NA是阿伏加德罗常数的值,下列说法正确的是
2FeSO4+2H2SO4。已知NA是阿伏加德罗常数的值,下列说法正确的是
A.FeSO4和H2SO4都是离子化合物,均属于强电解质
B.0.1 mol·L-1 FeSO4 溶液中Fe2+离子的浓度为0.1 mol·L-1
C.FeSO4既是被氧化得到的产物,又是被还原得到的产物
D.当转移2 mol电子时,消耗氧气的体积(标准状况)约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述违背化学原理的是
A.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
B.反应A(g)+3B(g)![]() 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大
2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大
C.SO2的催化氧化是一个放热的反应,升高温度,反应速率加快
D.多元弱酸各步电离常数相互关系为K1![]() K2
K2![]() K3
K3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com