
����Ŀ�����ܺͼ��Ž����Ѻ������ı�Ȼѡ�ش��������⣺
(1)��֪��һ���¶��£���C(s)+CO2(g) ![]() 2CO(g) ��H1=a kJ��mol-1 ƽ�ⳣ��K1��
2CO(g) ��H1=a kJ��mol-1 ƽ�ⳣ��K1��
��CO(g)+H2O(g) ![]() H2(g)+CO2(g) ��H2=b kJ��mol-1 ƽ�ⳣ��K2��
H2(g)+CO2(g) ��H2=b kJ��mol-1 ƽ�ⳣ��K2��
ij��Ӧ��ƽ�ⳣ������ʽK3= ![]() ����д���˷�Ӧ���Ȼ�ѧ����ʽ______________��K1��K2��K3֮��Ĺ�ϵ��_____________��
����д���˷�Ӧ���Ȼ�ѧ����ʽ______________��K1��K2��K3֮��Ĺ�ϵ��_____________��
(2)��ԭ������n(CO2)��n(H2)=1��4�����ܱ������з���CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)��Ӧ�����H2O(g)�����ʵ����������¶ȵĹ�ϵ����ͼ��ʾ��
CH4(g)+2H2O(g)��Ӧ�����H2O(g)�����ʵ����������¶ȵĹ�ϵ����ͼ��ʾ��
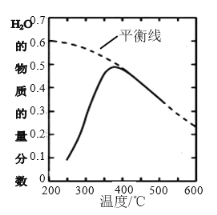
���÷�Ӧ��ƽ�ⳣ��K���¶Ƚ��Ͷ�________�������С������
�����ܱպ��£�����100��������װ���н��и÷�Ӧ���ﵽƽ��״̬����________��
a����������ܶȲ��ٸı� b���������ѹǿ���ٸı�
c���������ƽ��Ħ���������ٸı� d��n(CO2)��n(H2)=1:2
��200���ﵽƽ��ʱ��ϵ����ѹǿΪP���÷�Ӧƽ�ⳣ��Kp�ļ������ʽΪ______�����ػ�����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
(3)500��ʱ��CO��ˮ��Ӧ����CO2��H2���������õ�H2�Ĺ���ʾ��ͼ���£�

��������Ӧʽ��_______________________________________________��
����ϵ缫��Ӧʽ������K2CO3��Һ������ԭ��___________________��
���𰸡�C(s)+H2O(g) ![]() CO(g)+H2(g) ��H= (a+b) kJ��mol-1 K3= K1��K2 ���� bc
CO(g)+H2(g) ��H= (a+b) kJ��mol-1 K3= K1��K2 ���� bc ![]() 2H2O-4e-=O2+4H+ ������Ӧ��2H2O+2e-=H2��+2OH-��OH-+HCO3-=CO32-+H2O��ʹK2CO3��Һ��������
2H2O-4e-=O2+4H+ ������Ӧ��2H2O+2e-=H2��+2OH-��OH-+HCO3-=CO32-+H2O��ʹK2CO3��Һ��������
��������
(1) ƽ�ⳣ��Ϊ�������Ũ����֮�����Է�Ӧ���Ũ����֮����ƽ�ⳣ���У�����Ϊ�������ĸΪ��Ӧ��������㶨�ɷ������⣻����ƽ�ⳣ���ı���ʽ�ƶϣ�
(2)�ٸ���ƽ���߷������¶Ƚ��ͣ�H2O�����ʵ��������������¶Ƚ��������ڷ�Ӧ������У�
�ڸ���ƽ��״̬��������һ�����жϣ��ر�ע����������ܶ�Ϊ����![]() ����������ƽ����Է���������СΪ
����������ƽ����Է���������СΪ![]() ��
��
�۸��ݷ���ʽ����ƽ��ʱ����ֵķ�ѹ�������ѹƽ�ⳣ������ʽ���㣻
(3) CO2��H2��K2CO3��Һϴ�Ӻ��ݳ�H2��ͬʱ�õ�KHCO3��Һ�����ö��Ե缫���KHCO3��Һ��������H2���ɣ�������CO2��O2���ɡ�
(1)ij��Ӧ��ƽ�ⳣ������ʽK3=![]() ����������ΪCO��H2����Ӧ����H2O�����ԭ���غ��֪����һ�ַ�Ӧ����C����Ϊ��̬����˷�Ӧ�Ļ�ѧ����ʽΪC(s)+H2O(g)
����������ΪCO��H2����Ӧ����H2O�����ԭ���غ��֪����һ�ַ�Ӧ����C����Ϊ��̬����˷�Ӧ�Ļ�ѧ����ʽΪC(s)+H2O(g)![]() CO(g)+H2(g)����֪����C(s)+CO2(g)
CO(g)+H2(g)����֪����C(s)+CO2(g)![]() 2CO(g) ��H1=a kJ��mol-1ƽ�ⳣ��K1=
2CO(g) ��H1=a kJ��mol-1ƽ�ⳣ��K1=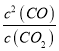 ����CO(g)+H2O(g)
����CO(g)+H2O(g)![]() H2(g)+CO2(g) ��H2=b kJ��mol-1ƽ�ⳣ��K2=
H2(g)+CO2(g) ��H2=b kJ��mol-1ƽ�ⳣ��K2=![]() �����ݸ�˹���ɣ���+�ڿɵ�C(s)+H2O(g)
�����ݸ�˹���ɣ���+�ڿɵ�C(s)+H2O(g)![]() CO(g)+H2(g)������H= (a+b) kJ��mol-1���ʸ÷�Ӧ�Ļ�ѧ����ʽΪC(s)+H2O(g)
CO(g)+H2(g)������H= (a+b) kJ��mol-1���ʸ÷�Ӧ�Ļ�ѧ����ʽΪC(s)+H2O(g)![]() CO(g)+H2(g) ��H= (a+b) kJ��mol-1��K3=
CO(g)+H2(g) ��H= (a+b) kJ��mol-1��K3=![]() =
=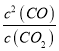 ��
��![]() =K1��K2��
=K1��K2��
(2)�ٸ���ƽ���߷������¶Ƚ��ͣ�H2O�����ʵ��������������¶Ƚ��������ڷ�Ӧ������У����Ը÷�Ӧ��ƽ�ⳣ��K���¶Ƚ��Ͷ�����
��a�����������ܶ�Ϊ����![]() ����Ӧǰ�������غ㣬��������m���䣬�����ݻ�V���䣬���Ի��������ܶ�ʼ�ղ��䣬����˵����Ӧ�Ƿ�ﵽ��ѧƽ�⣬������
����Ӧǰ�������غ㣬��������m���䣬�����ݻ�V���䣬���Ի��������ܶ�ʼ�ղ��䣬����˵����Ӧ�Ƿ�ﵽ��ѧƽ�⣬������
b����Ӧǰ������������ı䣬ѹǿ�仯������ͨ��ѹǿ�жϻ�ѧ��Ӧ�Ƿ�ﵽ��ѧƽ�⣬��b��ȷ��
c����������ƽ����Է���������СΪ![]() ����Ӧǰ��m���䣬n�ı䣬����ͨ����������ƽ����Է��������仯�жϻ�ѧ��Ӧ�Ƿ�ﵽ��ѧƽ�⣬��c��ȷ��
����Ӧǰ��m���䣬n�ı䣬����ͨ����������ƽ����Է��������仯�жϻ�ѧ��Ӧ�Ƿ�ﵽ��ѧƽ�⣬��c��ȷ��
d��CO2��H2�����ʵ���֮��ȡ���ڶ��ߵij������ͻ�ѧ��Ӧ����������ͨ��n(CO2)��n(H2)=1��2˵����ѧ��Ӧ�Ƿ�ﵽ��ѧƽ�⣬��d����
�ʴ�Ϊbc��
�۽�ԭ������n(CO2)��n(H2)=1��4�����ܱ������з���CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)��Ӧ������ȡ1molCO2��4molH2��
CH4(g)+2H2O(g)��Ӧ������ȡ1molCO2��4molH2��
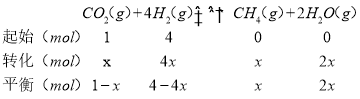
200��ﵽƽ��ʱH2O�����ʵ�������Ϊ0.6����![]() ��0.6���ɵ�x=
��0.6���ɵ�x=![]() ������ƽ����ϵ�У�p(CO2)=0.6p��p(CH4)=0.3p��p(CO2)=0.02p��p(H2)=0.08p����÷�Ӧƽ�ⳣ��Kp�ļ������ʽΪKp=
������ƽ����ϵ�У�p(CO2)=0.6p��p(CH4)=0.3p��p(CO2)=0.02p��p(H2)=0.08p����÷�Ӧƽ�ⳣ��Kp�ļ������ʽΪKp=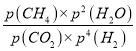 =
=![]() ��
��
(3)����������������Ӧ���缫��Ӧʽ��2H2O-4e-=O2+4H+��
�ڽ����ճ��е���Һ��⣬��������CO2��������O2����������K2CO3�����ʱH2O�ŵ����OH-��OH-��HCO3-��Ӧ����CO32-���ﵽ������Ŀ�ģ����Խ���Ϊ��������Ӧ��2H2O+2e-=H2��+2OH-��OH-+HCO3-=CO32-+H2O��ʹK2CO3��Һ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����Ȼ���е�ѭ������ͼ����˵������ȷ���ǣ�

A. ��Ԫ�ؾ�������
B. ��ҵ�ϳɰ������˹��̵�
C. ��������ͺ����л�����ת��
D. ̼���⡢������Ԫ��Ҳ�����˵�ѭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
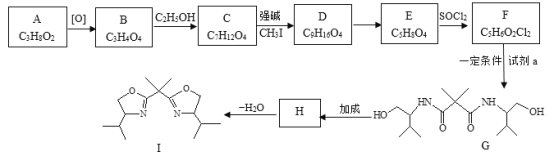
����Ŀ��˫�������Դ�����ҩ��ϳ�������Ҫ�����á�����һ�ִ���I�ĺϳ�·�����£�
��֪��R-NH2+![]()
![]()
![]()
(1)A����Na��Ӧ������H2����A�еĹ�����������_________��
(2)���й���A��˵���У���ȷ����_________��
a.���Ҵ���Ϊͬϵ��
b.��B��һ�������¿ɷ������۷�Ӧ
c.������ȥ��Ӧ���Լ��������ǣ�NaOH�Ĵ���Һ������
(3)д��B��C�Ļ�ѧ����ʽ��___________��
(4)D�Ľṹ��ʽ��__________��
(5)E��F�ķ�Ӧ������___________��
(6)��֪��NH3+![]() ��H2N-CH2CH2OH��NH3������K������Ӧ�����Ʊ��Լ�a��K�Ľṹ��ʽ��__________��
��H2N-CH2CH2OH��NH3������K������Ӧ�����Ʊ��Լ�a��K�Ľṹ��ʽ��__________��
(7)F��Ա�����(![]() )��һ�������¿ɷ������۷�Ӧ�Ʊ�����MXD6������Ʒ���÷�Ӧ�Ļ�ѧ����ʽ��___________��
)��һ�������¿ɷ������۷�Ӧ�Ʊ�����MXD6������Ʒ���÷�Ӧ�Ļ�ѧ����ʽ��___________��
(8)H�Ľṹ��ʽ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ������ȷ����
A.(NH4)2 Fe(SO4)2 �ܽ���ˮ��(NH4)2 Fe(SO4)2 ![]() 2NH4+ + Fe2 + + 2SO42��
2NH4+ + Fe2 + + 2SO42��
B.Al(OH)3��ˮ�еĵ��룺H+ + H2O+ AlO2��![]() Al(OH)3
Al(OH)3 ![]() Al3 ++3OH��
Al3 ++3OH��
C.H3PO4�ܽ���ˮ��H3PO4 ![]() 3H+ + PO43��
3H+ + PO43��
D.NaHSO3��ˮ�еĵ��룺HSO3�� + H2O ![]() SO32��+ H3O+
SO32��+ H3O+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Υ����ѧԭ������
A.������ˮΪ֮��������ˮ��˵����ͬ������ˮ�ͱ���ˮ��������
B.��ӦA(g)+3B(g)![]() 2C(g)��ƽ����¶Ȳ��䣬����ѹǿ��ƽ�������ƶ���ƽ�ⳣ��Kֵ����
2C(g)��ƽ����¶Ȳ��䣬����ѹǿ��ƽ�������ƶ���ƽ�ⳣ��Kֵ����
C.SO2�Ĵ�������һ�����ȵķ�Ӧ�������¶ȣ���Ӧ���ʼӿ�
D.��Ԫ����������볣�����ϵΪK1![]() K2
K2![]() K3
K3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2 L�����ܱ������г���![]() ��
��![]() ����һ�������·������·�Ӧ��
����һ�������·������·�Ӧ��![]()
![]() ��CO��ƽ��ת�������¶ȡ�ѹǿ֮��Ĺ�ϵ��ͼ��ʾ�������ƶ���ȷ���ǣ� ��
��CO��ƽ��ת�������¶ȡ�ѹǿ֮��Ĺ�ϵ��ͼ��ʾ�������ƶ���ȷ���ǣ� ��
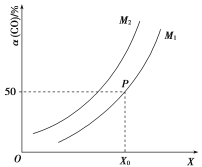
A.��ҵ�ϣ�����������Ӧ�ϳɼ״����¶�Խ��Խ��
B.ͼ����X�����¶ȣ�![]()
C.ͼ����P�������ƽ�ⳣ��KΪ![]()
D.�¶Ⱥ��ݻ����䣬�ٳ���![]() ��1 mol CO���ﵽƽ��ʱCO��ת���ʼ�С
��1 mol CO���ﵽƽ��ʱCO��ת���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����۳��д�ѧ֧�����Ŷ��з���Zn/��Co����Co3O4��أ���ͼ����ZnSO4��CoSO4Ϊ�������Һ����ŵ������a������CoO��Co3O4֮���ת�����Ӷ��ܺõؿ˷���֮ǰ����пһ�ܵ�ص�ȱ�ݡ�����˵���������
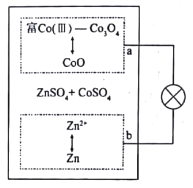
A.�ŵ�ʱ����Һ��Co2+Ũ�Ȳ���
B.���ʱ����Һ��SO42-����a��
C.���ʱ�����·ͨ��2mole���������ϵ������Һ��������6g
D.��Ϊ���Խ��ʣ��ή�͵缫�Ŀ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������������� ��NaCl�����Һ̬SO2�۱���������ᱵ��ͭ�ƾ���C2H5OH�����ۻ���KCl��NaOH��Һ����ˮ�ⴿ���ᣬ�����������ʻش��������⡣
����ǿ�������������״̬���ܵ������____________������������ʵ���_____________�� ���ڷǵ���ʣ�������ˮ���ˮ��Һ�ܵ������______________��
��2�����ܱ������У�ʹ1 mol N2��3 mol H2��Ϸ������з�Ӧ��N2 (g)+3H2 (g)![]() 2NH3 (g) ��H ��0��
2NH3 (g) ��H ��0��
�ٴﵽƽ��ʱ�� ����N2������������䣬ƽ�⽫______�ƶ�����������������������������������
�ڴﵽƽ��ʱ�����������Ar��������������䣬ƽ�⽫______�ƶ���ͬ�ϣ���
�۴ﵽƽ��ʱ�����������Ar����������ѹǿ���䣬ƽ�⽫______�ƶ���ͬ�ϣ���
�ܴﵽƽ��ʱ����c��N2����c��H2����c��NH3��ͬʱ����1����ƽ��______�ƶ���ͬ�ϣ���
�ݱ���������䣬�����¶�ʱ����������ƽ����Է�������______���ܶ�_______�����������������С����������������
����Ӧ�ﵽƽ��ʱ��N2��H2��Ũ�ȱ���______��N2��H2��ת���ʱ���______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���뻯ѧƽ�����ƣ�����ƽ���ƽ�ⳣ�����������볣��(��K��ʾ)���±���ij�¶��¼��ֳ�������ĵ���ƽ�ⳣ����
�� | ���뷽��ʽ | ����ƽ�ⳣ��K |
CH3COOH | CH3COOH | 2��10��5 |
HClO | HClO | 3.0��10��8 |
H2CO3 | H2CO3 HCO3�� | K1=4.4��10��7 K2=5.61��10��11 |
H3PO4 | H3PO4 H2PO4�� HPO42�� | K1=7.1��10��3 K2=6.3��10��8 K3=4.2��10��13 |
�ش��������⣺
(1)����CH3COOH��HClO��H2CO3��HCO3����H3PO4��H2PO4����HPO42�����������ᣬ������������ǿ����_______(�ѧʽ����ͬ)����������________��
(2)��NaClO��Һ��ͨ�������Ķ�����̼�����������ӷ���ʽΪ_______��
(3)������¶��£�0.10molL��
(4)���¶���0.1mol/L��CH3COOH��Һ��ˮϡ���̣����б���ʽ������һ���������____��
A��c(H+) B��c(H+)c(CH3COO��) C��c(H+)c(OH��) D��c(OH��)/c(H+)
(5)ȡ�������pH��Ϊa�Ĵ���ʹ���������Һ���ֱ��õ�Ũ�ȵ�NaOHϡ��Һǡ���кͣ����ĵ�NaOH��Һ������ֱ�ΪV1��V2�����С��ϵΪ��V1_____V2( ��������������������=��)��
(6)�����������ӽ��H+������ǿ����_______��
A��HCO3�� B��CO32�� C��ClO�� D��CH3COO��
(7)�����ʵ����Ŀ����Ʒֱ���pHΪ2��3�Ĵ�����Һ�кͣ������Ĵ�����Һ���������ΪVa��Vb�������ߵĹ�ϵ��ȷ������_________��
A��Va��10Vb B��Va��10Vb C��Vb ��10 Va D��Vb��10Va
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com