
【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 2×10﹣5 |
HClO | HClO | 3.0×10﹣8 |
H2CO3 | H2CO3 HCO3﹣ | K1=4.4×10﹣7 K2=5.61×10﹣11 |
H3PO4 | H3PO4 H2PO4﹣ HPO42﹣ | K1=7.1×10﹣3 K2=6.3×10﹣8 K3=4.2×10﹣13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3﹣、H3PO4、H2PO4﹣、HPO42﹣都看作是酸,则它们酸性最强的是_______(填化学式,下同),最弱的是________。
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为_______。
(3)求出该温度下,0.10molL﹣
(4)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是____。
A.c(H+) B.c(H+)c(CH3COO﹣) C.c(H+)c(OH﹣) D.c(OH﹣)/c(H+)
(5)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1_____V2( 填“>”、“<”或“=”)。
(6)下列四种离子结合H+能力最强的是_______。
A.HCO3﹣ B.CO32﹣ C.ClO﹣ D.CH3COO﹣
(7)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是(_________)
A.Va>10Vb B.Va<10Vb C.Vb <10 Va D.Vb>10Va
【答案】H3PO4 HPO42﹣ CO2+ClO﹣+H2O═HClO+HCO3﹣ 1.4×10﹣3 D < B D
【解析】
(1)同一温度下,酸的电离平衡常数越大其酸性越强,根据酸的电离平衡常数确定酸性强弱;
(2)根据酸性:H2CO3>HClO>HCO3-,分析判断生成物,再书写反应的离子方程式;
(3)依据电离平衡常数计算氢离子浓度;
(4)CH3COOH溶液加水稀释过程,促进电离,但溶液中的主要离子浓度均会减小,c(OH-)增大,结合温度不变,平衡常数和水的离子积常数不变分析判断;
(5)根据酸性:CH3COOH>HClO,pH相等的醋酸和次氯酸,次氯酸的浓度大于醋酸,据此分析解答;
(6)电离平衡常数越大,酸的电离程度越大,溶液酸性越强,对应阴离子结合氢离子的能力越弱,据此分析判断;
(7)醋酸为弱电解质,浓度越大,电离程度越小,pH为2和3的CH3COOH溶液,后者电离程度大;等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,需要二者物质的量相等,据此分析判断。
(1)同一温度下,酸的电离平衡常数越大,其酸性越强,根据酸的电离平衡常数知,它们酸性强弱顺序是:H3PO4>CH3COOH>H2CO3>H2PO4->HClO>HCO3->HPO42-,所以酸性最强的是H3PO4,最弱的是HPO42-,故答案为:H3PO4;HPO42-;
(2)因为酸性:H2CO3>HClO>HCO3-,碳酸的酸性强于次氯酸,所以反应的离子方程式为:CO2+ClO-+H2O═HClO+HCO3-,故答案为:CO2+ClO-+H2O═HClO+HCO3-;
(3)该温度下,0.10molL-1的CH3COOH溶液中存在电离平衡,CH3COOHCH3COO-+H+,平衡常数K=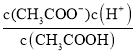 =2×10-5,c2(H+)=0.10×2×10-5 ,c(H+)≈1.4×10-3 mol/L,故答案为:1.4×10-3;
=2×10-5,c2(H+)=0.10×2×10-5 ,c(H+)≈1.4×10-3 mol/L,故答案为:1.4×10-3;
(4)A.CH3COOH溶液加水稀释,尽管促进醋酸电离,但c(H+)仍减小,故A错误;B.c(H+)c(CH3COO﹣)=K×c(CH3COOH),CH3COOH溶液加水稀释,促进醋酸电离,c(CH3COOH)减小,温度不变,K不变,因此c(H+)c(CH3COO﹣)减小,故B错误;C.CH3COOH溶液加水稀释,促进醋酸电离,c(H+)减小,c(OH-)增大,c(H+)c(OH-)=Kw,但温度不变,Kw不变,故C错误;D.CH3COOH溶液加水稀释,促进醋酸电离,c(H+)减小,c(OH-)增大,则c(OH﹣)/c(H+)比值增大,故D正确;故答案为:D;
(5)pH相等的醋酸和次氯酸,次氯酸的浓度大于醋酸,等体积等pH的两种酸,次氯酸的物质的量大于醋酸,酸的物质的量越多,恰好中和需要等浓度的氢氧化钠溶液体积越大,所以消耗的NaOH溶液的体积大小关系为:V1<V2,故答案为:<;
(6)电离平衡常数越大,酸的电离程度越大,溶液酸性越强,根据表中数据可知,酸性由强到弱的顺序为:CH3COOH>H2CO3>HClO>HCO3-,酸性越弱,对应的酸根离子结合氢离子的能力越强,则结合氢离子能力最强的为CO32-,故答案为:B;
(7)等物质的量的NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,则需要的醋酸的物质的量相等,因为所中和的氢氧化钠的物质的量是一定的,而醋酸是弱酸,浓度越大,电离程度越小,则pH为2和3的CH3COOH溶液,后者电离程度大,pH为2的CH3COOH的浓度大于pH为3的CH3COOH溶液的浓度的10倍,设pH为2的醋酸浓度为x,pH=3的醋酸浓度为y,则有Va×x=Vb×y,
则![]() =
=![]() <
<![]() ,即Vb>10Va,故选D。
,即Vb>10Va,故选D。


科目:高中化学 来源: 题型:
【题目】节能和减排建设友好型社会的必然选择。回答下列问题:
(1)已知在一定温度下,①C(s)+CO2(g) ![]() 2CO(g) ΔH1=a kJ·mol-1 平衡常数K1;
2CO(g) ΔH1=a kJ·mol-1 平衡常数K1;
②CO(g)+H2O(g) ![]() H2(g)+CO2(g) ΔH2=b kJ·mol-1 平衡常数K2。
H2(g)+CO2(g) ΔH2=b kJ·mol-1 平衡常数K2。
某反应的平衡常数表达式K3= ![]() ,请写出此反应的热化学方程式______________,K1、K2、K3之间的关系是_____________。
,请写出此反应的热化学方程式______________,K1、K2、K3之间的关系是_____________。
(2)将原料气按n(CO2)∶n(H2)=1∶4置于密闭容器中发生CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如下图所示:
CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如下图所示:
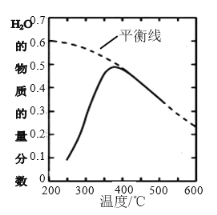
①该反应的平衡常数K随温度降低而________(填“增大”或“减小”)。
②在密闭恒温(高于100℃)恒容装置中进行该反应,达到平衡状态的是________。
a.混合气体密度不再改变 b.混合气体压强不再改变
c.混合气体平均摩尔质量不再改变 d.n(CO2)∶n(H2)=1:2
③200℃达到平衡时体系的总压强为P,该反应平衡常数Kp的计算表达式为______(不必化简,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)500℃时,CO与水反应生成CO2和H2,将其分离得到H2的过程示意图如下:

①阳极反应式是_______________________________________________。
②结合电极反应式,简述K2CO3溶液的再生原理___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容密闭容器中,可逆反应2NO2(g)![]() 2NO(g)+ O2(g)达到平衡状态的标志是
2NO(g)+ O2(g)达到平衡状态的标志是
①2V(O2)=V(NO2)
②单位时间内生成n molO2的同时生成2n molNO2
③NO2、NO、O2的浓度之比为2∶2∶1
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变
A.②④⑥ B.①④⑥ C.②④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期的A、B、C、D、E五种元素,原子序数逐渐增大。A元素核外有三个电子层,最外层电子数是核外电子总数的1/6;B元素核外只有一个未成对电子,能与水剧烈反应;C元素正三价离子的3d轨道为半充满状态;D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;E元素的价电子构型为nsanpa+1,其某种氧化物有剧毒。
(1)A元素的第一电离能___Al元素的第一电离能(填“<”“>”或“=”),请解释原因___。
(2)写出B2O2与H2O反应过程中断裂的化学键的种类___。
(3)C元素位于元素周期表的___区,它的价电子排布式是___,C(CO)x的中心原子价电子数与配位数提供的电子数之和为18,则x=___。
(4)D2O的熔点比D2S的熔点高,其原因是___。
(5)ECl3分子的立体构型为___,其中E的杂化类型为___,E元素可能的性质为___(从下列选项中选择)。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
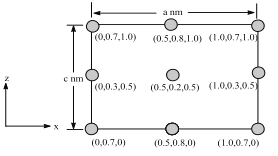
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。BSiAl3O7属于正交晶系(长方体形),晶胞参数为anm、bnm、cnm。如图为沿y轴投影的晶胞中所有B原子的分布图和原子分数坐标。据此推断该晶胞中B原子数目为___;BSiAl3O7的摩尔质量为Mgmol-1,设NA为阿伏伽德罗常数的值,则晶体的密度=___(gcm3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)
A. 11.52 B. 11.70
C. 11.82 D. 12.00
查看答案和解析>>
科目:高中化学 来源: 题型:
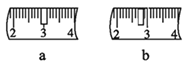
【题目】配制一定物质的量浓度的溶液,几个关键实验步骤和操作如图:

(1)现需要94 mL 0.10 mol·L-1 Na2CO3溶液,进行现场配制。上述实验步骤A~F正确的实验次序为_______________________(填字母)。步骤E中将一玻璃仪器上下颠倒数次,写出该仪器的名称_________________。
(2)步骤C通常称为溶解,步骤A通常称为_________。
(3)用Na2CO3·10H2O来配制该溶液,托盘天平称取样品,游码需要打在图示________(填a或b)位置,若称量前晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏_______(填“大”或“小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是( )

A. 开始时产生的气体为H2
B. AB段发生的反应为置换反应
C. 参加反应铁粉的总质量m2=5.6 g
D. 所用混合溶液中c(HNO3)=0.5 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在C(s)+CO2(g)![]() 2CO(g)反应中,可使反应速率增大的措施是
2CO(g)反应中,可使反应速率增大的措施是
①压缩容器体积 ②增加炭的量 ③恒容下通入CO2 ④恒压下充入N2 ⑤恒容下充入N2 ⑥升高温度
A.①③⑥B.②④⑥C.①③④D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制取纯净氯气的装置图,下列说法正确的是( )
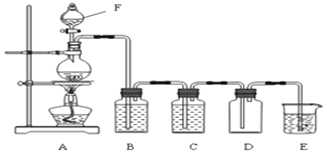
A.分液漏斗中盛装的是浓硫酸
B.B的目的是为了除去氯气中的水分
C.E的目的是为了处理过量的氯气,E中盛装的是Ca(OH)2溶液
D.D广口瓶除了可以用于收集气体外,还可以用做安全瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com