
【题目】前四周期的A、B、C、D、E五种元素,原子序数逐渐增大。A元素核外有三个电子层,最外层电子数是核外电子总数的1/6;B元素核外只有一个未成对电子,能与水剧烈反应;C元素正三价离子的3d轨道为半充满状态;D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;E元素的价电子构型为nsanpa+1,其某种氧化物有剧毒。
(1)A元素的第一电离能___Al元素的第一电离能(填“<”“>”或“=”),请解释原因___。
(2)写出B2O2与H2O反应过程中断裂的化学键的种类___。
(3)C元素位于元素周期表的___区,它的价电子排布式是___,C(CO)x的中心原子价电子数与配位数提供的电子数之和为18,则x=___。
(4)D2O的熔点比D2S的熔点高,其原因是___。
(5)ECl3分子的立体构型为___,其中E的杂化类型为___,E元素可能的性质为___(从下列选项中选择)。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
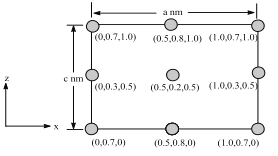
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。BSiAl3O7属于正交晶系(长方体形),晶胞参数为anm、bnm、cnm。如图为沿y轴投影的晶胞中所有B原子的分布图和原子分数坐标。据此推断该晶胞中B原子数目为___;BSiAl3O7的摩尔质量为Mgmol-1,设NA为阿伏伽德罗常数的值,则晶体的密度=___(gcm3)。
【答案】> 镁原子的价电子排布为3s2,处于全充满状态,比较稳定,失去电子较难 离子键、非极性共价键、极性共价键(或离子键、共价键) d 3d64s2 5 二者都是离子晶体,O2-与S2-所带的电荷相同,但O2-半径小于S2-,Cu2O的晶格能大于Cu2S 三角锥形 sp3 A 4 ![]()
【解析】
前四周期的A、B、C、D、E五种元素,原子序数逐渐增大。A元素核外有三个电子层,最外层电子数是核外电子总数的1/6,令A的最外层电子数为x,则2+8+x=6x,x=2,故A为Mg;B元素核外只有一个未成对电子,能与水剧烈反应,B为K;C元素正三价离子的3d轨道为半充满状态,C为Fe;D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子D为Cu;E元素的价电子构型为nsanpa+1,s能级最多有2个电子,故a=2,所以E元素的价电子构型为ns2np3,E为第ⅤA族元素,其某种氧化物有剧毒,E为As。
(1)同周期第ⅡA族元素的第一电离能大于第ⅢA族元素的第一电离能;
(2)K2O2与H2O反应的化学方程式为2 K2O2+2H2O= O2↑+2KOH,从K2O2与H2O反应的化学方程式中判断反应过程中断裂的化学键的种类;
(3)依据Fe元素的原子序数,以及基态原子核外电子排布式判断Fe元素位于元素周期表的哪个区;
(4)利用影响晶格能大小的因素比较Cu2O、Cu2S熔点的高低;
(5)计算出AsCl3的价层电子对数、中心原子的孤电子对数,判断出分子构型依及中心原子的杂化类型;
(6)先分析得出K原子的个数,再根据公式计算密度。
由分析知A为Mg、B为K、C为Fe、D为Cu、E为As。
(1)镁原子的价电子排布为3s2,处于全充满状态,比较稳定,失去电子较难,故Mg元素的第一电离能大于Al元素的第一电离能;
(2)B2O2为K2O2,其与H2O反应的化学方程式为2 K2O2+2H2O= O2↑+2KOH,该反应过程中断裂的化学键为离子键、非极性共价键、极性共价键(或离子键、共价键);
(3)C元素为Fe,原子序数为26,位于元素周期表的d区,它的基态原子核外电子排布式为[Ar]3d64s2,故其价电子排布式是3d64s2;Fe(CO)x的中心原子价电子数与配位数提供的电子数之和为18,Fe(CO)x中一个CO提供2个电子,与Fe形成一个配位键,8+2x=18,x=5;
(4)Cu2O与Cu2S二者都是离子晶体,O2-与S2-所带的电荷相同,但O2-半径小于S2-,Cu2O的晶格能大于Cu2S ,故Cu2O的熔点比Cu2S的熔点高;
(5)AsCl3的价层电子对数为4,中心原子As有1对孤电子对,其分子的立体构型为三角锥形,其中As的杂化类型为sp3;As在周期表中位于金属与非金属交界处,故As的单质可作为半导体材料,A正确;同主族从上到下,随着核电荷数的增加,电负性逐渐减小,As的电负性小于P的电负性,B错误;H3AsO4为弱酸,C错误;
(6)KSiAl3O7属于正交晶系(长方体形),原子分数坐标为(0.5,0.2,0.5)的K原子位于体内,原子分数坐标为(0,0.3,0.5)及 (1.0,0.3,0.5) 的K原子分别位于晶胞的左侧面、右侧面,原子分数坐标为(0.5,0.8,1.0)及(0.5,0.8,0)的K原子分别位于晶胞的上底面、下底面,原子分数坐标为(0,0.7,1.0)、(1.0,0.7,1.0)、(0,0.7,0)及(1.0,0.7,0) 的K原子位于晶胞平行于y轴的棱上,则晶胞中K原子的数目为:1+4×![]() +4×
+4×![]() ,由化学式KSiAl3O7,可知晶胞中相当于含有4个“KSiAl3O7”,令晶胞的密度为
,由化学式KSiAl3O7,可知晶胞中相当于含有4个“KSiAl3O7”,令晶胞的密度为![]() ,则(a×10-7)×(b×10-7)×
,则(a×10-7)×(b×10-7)×
(c×10-7)×![]() ×NA=4M,解得
×NA=4M,解得![]() =
=![]() (gcm3)。
(gcm3)。


科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3CO3H)是一种广谱高效消毒剂,不稳定、易分解,高浓度易爆炸。常用于空气、器材的消毒,可由乙酸与H2O2在硫酸催化下反应制得,热化学方程式为:CH3COOH(aq)+H2O2(aq)CH3CO3H(aq)+H2O(l) △H=-13.7KJ/mol
(1)市售过氧乙酸的浓度一般不超过21%,原因是____ 。
(2)利用上述反应制备760 9 CH3CO3H,放出的热量为____kJ。
(3)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25 ℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应,测定24小时所得溶液中过氧乙酸的质量分数,数据如图2所示。
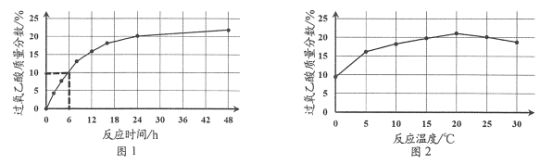
①实验1中,若反应混合液的总质量为mg,依据图1数据计算,在0—6h间,v(CH3CO3H)=____ g/h(用含m的代数式表示)。
②综合图1、图2分析,与20 ℃相比,25 ℃时过氧乙酸产率降低的可能原因是_________。(写出2条)。
(4) SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40 nm和70 nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
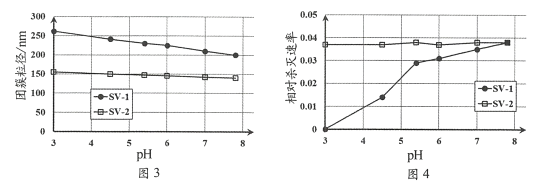
依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是______
查看答案和解析>>
科目:高中化学 来源: 题型:
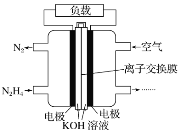
【题目】某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。
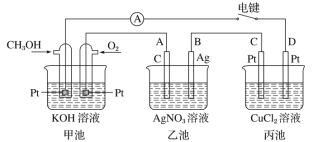
请回答下列问题:
(1)甲池为_______(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为_______。
(2)乙池中A(石墨)电极的名称为_____(填“正极”“负极”“阴极”或“阳极”),总反应式为______。
(3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为___mL(标准状况下),丙池中___极(填C或D)析出___g铜。
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将______(填“增大”“减小”或“不变”);丙中溶液的pH将______(填“增大”“减小”或“不变”)。
(5)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为_____;正极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1molL1的NaOH溶液逐渐加到5mL0.1molL1的一元酸HA溶液中,测得混合溶液的BG(BG=-lg![]() )与所加NaOH的体积的变化关系如图所示。
)与所加NaOH的体积的变化关系如图所示。
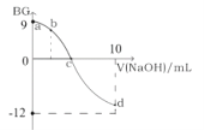
下列叙述错误的是( )
A.该滴定过程可选用酚酞做指示剂
B.c点所加的NaOH溶液的体积小于5mL
C.从a点到c点,水的电离程度一直增大
D.若b点所加的NaOH溶液的体积等于2.5mL,则所得溶液中:c(H+)=c(HA)+c(OH)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
A. Na2CO3和Na2O2 B. Na2CO3和NaOH
C. NaOH和Na2O2 D. NaOH、Na2O2和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是
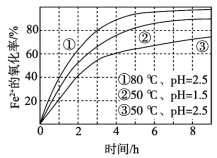
A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
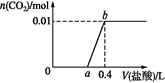
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】截止2020年4月5日,全球新型冠状病毒肺炎确诊超过120万例。以下对预防新冠病毒的认识,不符合科学道理的是( )
A | B | C | D |
|
|
|
|
84消毒液使用时不能和洁厕灵混用 | 医用酒精消毒效果浓度95%>75% | 口罩关键一层聚丙烯熔喷布属于有机高分子材料 | 温度计中水银属于金属单质 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1 mol·L-1 NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A.当pH=9时,溶液中存在下列关系:c(NH4+)>c(NH3·H2O)>c(HCO3-)>c(CO32-)
B.将0.2 mol CO2通入1 L 0.3 mol·L-1 NH3·H2O溶液中充分反应,则有:c(HCO3-)+3c(H2CO3)-c(CO32-)>0
C.向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D.分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com