
【题目】某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。
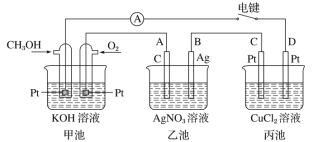
请回答下列问题:
(1)甲池为_______(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为_______。
(2)乙池中A(石墨)电极的名称为_____(填“正极”“负极”“阴极”或“阳极”),总反应式为______。
(3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为___mL(标准状况下),丙池中___极(填C或D)析出___g铜。
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将______(填“增大”“减小”或“不变”);丙中溶液的pH将______(填“增大”“减小”或“不变”)。
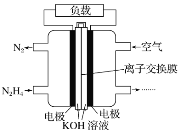
(5)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为_____;正极反应式为_______。
【答案】原电池 CH3OH-6e-+8OH-=CO32-+6H2O 阳极 4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3 280 D 1.60 减小 增大 N2H4-4e-+4OH-=N2↑+4H2O O2+4e-+2H2O=4OH-
4Ag+O2↑+4HNO3 280 D 1.60 减小 增大 N2H4-4e-+4OH-=N2↑+4H2O O2+4e-+2H2O=4OH-
【解析】
由图示可知甲池为甲醇燃料电池,燃料电池中通入燃料的一极为负极,通入氧气的一极为正极,则通入甲醇的一极为负极,燃料在负极失电子发生氧化反应,在碱溶液中生成碳酸盐,电极反应为:CH3OH+8OH--6e-=CO32-+6H2O,通入氧气的一极为正极,电极反应为O2+4e-+2H2O=4OH-;乙、丙二池为电解池,电解池中与电源正极相连的一极为阳极,与电源负极相连的一极为阴极,则A、C为两个电解池的阳极,B、D为两个电解池的阴极,乙池中电解质溶液为AgNO3,根据放电顺序,阳极A的电极反应为4OH--4e-=2H2O+O2↑,阴极B的电极反应为Ag++e-=Ag;丙池中电解质溶液为CuCl2,根据放电顺序,阳极C的电极反应为2Cl--2e-=Cl2↑,阴极D的电极反应为Cu2++2e-=Cu,据此分析解答(1)~ (4);
(5)燃料电池中,通入燃料的电极通常为负极,通入氧气的一极为正极,结合图示分析书写电极反应。
(1)根据分析,甲池为原电池,通入CH3OH电极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O;
(2)根据分析,乙池为电解池,A(石墨)电极的名称为阳极,阳极A的电极反应为4OH--4e-=2H2O+O2↑,阴极B的电极反应为Ag++e-=Ag,总反应式为4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3;
4Ag+O2↑+4HNO3;
(3)根据分析,乙池中阴极B的电极反应为Ag++e-=Ag,B极质量增加5.40 g时,即生成Ag单质的质量为5.40g,其物质的量=![]() =0.05mol,甲池中正极电极反应为O2+4e-+2H2O=4OH-,根据电子守恒计算4Ag~O2~4e-,甲池中理论上消耗O2的体积=
=0.05mol,甲池中正极电极反应为O2+4e-+2H2O=4OH-,根据电子守恒计算4Ag~O2~4e-,甲池中理论上消耗O2的体积=![]() mol×22.4L/mol =0.28L=280mL;丙为电解池,C为阳极,D为阴极,阴极D的电极反应为Cu2++2e-=Cu,结合电子守恒计算2Ag~Cu~2e-,析出铜质量=
mol×22.4L/mol =0.28L=280mL;丙为电解池,C为阳极,D为阴极,阴极D的电极反应为Cu2++2e-=Cu,结合电子守恒计算2Ag~Cu~2e-,析出铜质量=![]() ×64g/mol =1.60g;
×64g/mol =1.60g;
(4)甲中发生的反应为甲醇与氧气、氢氧化钾的反应,反应消耗氢氧根离子,则pH减小,丙中电极不变,将其溶液换成NaCl溶液,则丙中电解NaCl溶液生成氢氧化钠,所以溶液pH增大;
(5)燃料电池中,通入燃料的电极通常为负极,通入氧气的一极为正极,则通入液体燃料肼(N2H4)的一极为负极,负极发生氧化反应,由图可知负极上有N2生成,电极反应式为:N2H4-4e-+4OH-=N2↑+4H2O;通入氧气的一极为正极,正极发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-。


科目:高中化学 来源: 题型:
【题目】无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

(1)装置B中盛放饱和NaCl溶液,该装置的主要作用是_________;F中的试剂是__________。
(2)实验步骤:如图连接装置后,先___________(填实验操作),再装药品,然后点燃________(填“ A” 或“C” )处酒精灯,当_________(填实验现象)时,再点燃另一处酒精灯。
(3)写出装置G 中发生反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
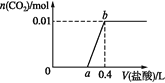
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
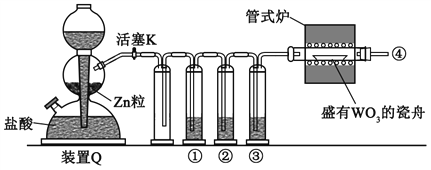
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四苯基乙烯(TPE)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。以下是TPE的两条合成路线(部分试剂及反应条件省略):
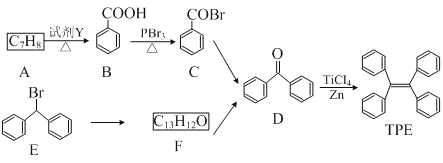
(1)A的名称是__________________;试剂Y为____________________。
(2)B→C的反应类型为_______________;B中官能团的名称是_________________,D中官能团的名称是_______________。
(3)E→F的化学方程式是______________________________________。
(4)W是D的同分异构体,具有下列结构特征:①属于萘(![]() )的一元取代物;②存在羟甲基(-CH2OH)。写出W所有可能的结构简式:______________________。
)的一元取代物;②存在羟甲基(-CH2OH)。写出W所有可能的结构简式:______________________。
(5)下列叙述正确的是______。
a. B的酸性比苯酚强
b. D不能发生还原反应
c. E含有3种不同化学环境的氢
d. TPE既属于芳香烃也属于烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有BaCl2和KCl的混合溶液V L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗a mol H2SO4;另一份滴加AgNO3溶液,消耗b mol AgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为___mol·L-1。
(2)一定条件下,PbO2与Cr3+反应,产物是![]() 和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为____mol;
和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为____mol;
(3)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为___________。
(4)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平。Al+NO3-+ —AlO2-+N2↑+H2O,_____________
(5)某化学反应的反应物和产物:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化产物是__________。
②若该反应方程式中I2和KIO3的计量数分别是是6和3,请在下边的化学式上用单线桥标出电子转移的方向和数目:KMnO4+KI+H2SO4→__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期的A、B、C、D、E五种元素,原子序数逐渐增大。A元素核外有三个电子层,最外层电子数是核外电子总数的1/6;B元素核外只有一个未成对电子,能与水剧烈反应;C元素正三价离子的3d轨道为半充满状态;D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;E元素的价电子构型为nsanpa+1,其某种氧化物有剧毒。
(1)A元素的第一电离能___Al元素的第一电离能(填“<”“>”或“=”),请解释原因___。
(2)写出B2O2与H2O反应过程中断裂的化学键的种类___。
(3)C元素位于元素周期表的___区,它的价电子排布式是___,C(CO)x的中心原子价电子数与配位数提供的电子数之和为18,则x=___。
(4)D2O的熔点比D2S的熔点高,其原因是___。
(5)ECl3分子的立体构型为___,其中E的杂化类型为___,E元素可能的性质为___(从下列选项中选择)。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
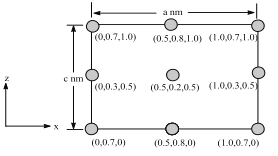
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。BSiAl3O7属于正交晶系(长方体形),晶胞参数为anm、bnm、cnm。如图为沿y轴投影的晶胞中所有B原子的分布图和原子分数坐标。据此推断该晶胞中B原子数目为___;BSiAl3O7的摩尔质量为Mgmol-1,设NA为阿伏伽德罗常数的值,则晶体的密度=___(gcm3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物结构的叙述不正确的是( )
A.一氟一氯甲烷只有一种结构,可以证明甲烷是正四面体结构
B.构成乙烯分子的所有原子都在同一平面内,其分子中只含有极性键
C.邻二甲苯没有同分异构体表明苯的凯库勒结构式不准确
D.![]() 和CH3一CH=CH2互为同分异构体
和CH3一CH=CH2互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com