
【题目】无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

(1)装置B中盛放饱和NaCl溶液,该装置的主要作用是_________;F中的试剂是__________。
(2)实验步骤:如图连接装置后,先___________(填实验操作),再装药品,然后点燃________(填“ A” 或“C” )处酒精灯,当_________(填实验现象)时,再点燃另一处酒精灯。
(3)写出装置G 中发生反应的离子方程式______________________。
【答案】除去氯气中混有的HCl气体 浓硫酸 检查装置的气密性 A D中充满黄绿色气体 Cl2 +2OH-=Cl- +ClO- +H2O
【解析】
在加热条件下,浓盐酸和二氧化锰发生反应方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,浓盐酸具有挥发性,所以生成的氯气中含有HCl,用饱和氯化钠溶液除去氯气中的HCl;因为无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,所以先用浓硫酸干燥氯气,再将氯气通入D装置中,D中反应方程式为2Al+3Cl2
MnCl2+Cl2↑+2H2O,浓盐酸具有挥发性,所以生成的氯气中含有HCl,用饱和氯化钠溶液除去氯气中的HCl;因为无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,所以先用浓硫酸干燥氯气,再将氯气通入D装置中,D中反应方程式为2Al+3Cl2![]() 2AlCl3;氯气有毒,不能直接排空,应该用NaOH溶液吸收氯气;F中加入浓硫酸,防止氢氧化钠溶液中的水蒸气进入E装置,据此分析解答。
2AlCl3;氯气有毒,不能直接排空,应该用NaOH溶液吸收氯气;F中加入浓硫酸,防止氢氧化钠溶液中的水蒸气进入E装置,据此分析解答。
根据分析,(1) 浓盐酸具有挥发性,所以A中生成的氯气中含有HCl,用饱和氯化钠溶液除去氯气中的HCl;装置B的主要作用是除去氯气中混有的HCl气体;无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,F中加入浓硫酸,可以防止氢氧化钠溶液中的水蒸气进入E装置,F中的试剂是浓硫酸。
(2)该实验涉及气体,为防止漏气,连接装置后,先检验装置气密性,再装药品;为防止铝和氧气反应生成氧化铝,先用氯气排出装置中的空气再加热铝粉,所以先点燃A处酒精灯,当D中充满黄绿色气体时,再点燃另一处酒精灯。
(3)装置G 中氯气和氢氧化钠反应生成氯化钠、次氯酸钠、水,发生反应的离子方程式是Cl2 +2OH-=Cl- +ClO- +H2O。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为_____。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为_____(已知该反应为置换反应),钠的原子结构示意图为________:
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为___。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为_____,CO2的结构式 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为了验证SO2的还原性并测定产生SO2的质量,组装了下图装置。回答下列问题:
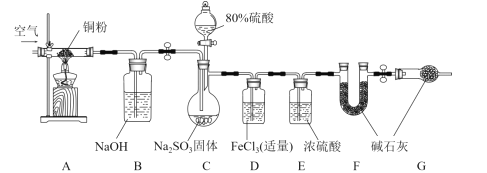
(1)C中发生反应的化学方程式是________,B装置的名称是_________,关于该套装置说法正确的是_________(填标号)。
a 组装仪器、加入药品后检查气密性 b 实验开始和最后时均需要通入空气
c 利用A、B装置是为了减小实验误差 d F、G中的碱石灰可以换为无水CaCl2
(2)甲同学认为很快可以看到D装置的现象,他的依据是_________(用离子方程式表示)。乙同学做实验时发现和甲同学预测的现象不一样,先出现棕红色,经过一段时间后变为浅绿色。于是查阅资料发现反应分为两步:
第一步:![]() (快反应)
(快反应)
第二步:![]() (慢反应)
(慢反应)
如果需要验证第一步反应是快反应,可以事先在D装置中滴加数滴_________试剂,相应的实验现象是________。
(3)学习小组通过实验后D和F装置中的数据来计算SO2的质量。D中加入足量的BaCl2溶液充分反应,经过________操作,测得沉淀为m1g,F的质量差为m2g,C中产生SO2的体积(标准状况下)为_________L。该实验的设计中,仍然存在系统误差的可能原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.H2O+Na2O=2NaOHB.2H2O+2F2=4HF+O2
C.2H2O![]() O2↑+2H2↑D.3NO2+H2O=2HNO3+NO
O2↑+2H2↑D.3NO2+H2O=2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:ClO-+CO2+ H2O =HClO+HCO3-
B.硅酸钠溶液与醋酸溶液混合: SiO32-+ 2H+ = H2SiO3↓
C.从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
D.Ca(ClO)2溶液中通入过量的SO2气体:ClO-+SO2+H2O===HClO+HSO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中![]() 的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
的含量变化来检测核电站是否发生放射性物质泄漏。下列有关![]() 的叙述中错误的是
的叙述中错误的是
A.![]() 的化学性质与
的化学性质与![]() 相同B.
相同B.![]() 与
与![]() 是同一种核素
是同一种核素
C.![]() 的中子数为78D.
的中子数为78D.![]() 与
与![]() 互为同位素
互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A..由H和Cl形成HCl的过程:![]()
B.常温时,饱和NaClO溶液的pH约为11:ClO-+H2O=HClO+OH-
C.苯酚和甲醛在一定条件下反应能生成酚醛树脂: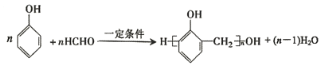
D.电解饱和食盐水的反应:2Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3CO3H)是一种广谱高效消毒剂,不稳定、易分解,高浓度易爆炸。常用于空气、器材的消毒,可由乙酸与H2O2在硫酸催化下反应制得,热化学方程式为:CH3COOH(aq)+H2O2(aq)CH3CO3H(aq)+H2O(l) △H=-13.7KJ/mol
(1)市售过氧乙酸的浓度一般不超过21%,原因是____ 。
(2)利用上述反应制备760 9 CH3CO3H,放出的热量为____kJ。
(3)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25 ℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应,测定24小时所得溶液中过氧乙酸的质量分数,数据如图2所示。
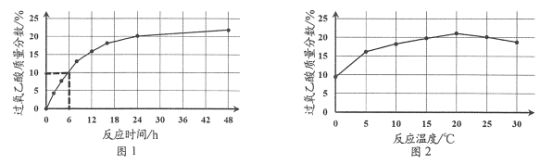
①实验1中,若反应混合液的总质量为mg,依据图1数据计算,在0—6h间,v(CH3CO3H)=____ g/h(用含m的代数式表示)。
②综合图1、图2分析,与20 ℃相比,25 ℃时过氧乙酸产率降低的可能原因是_________。(写出2条)。
(4) SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40 nm和70 nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
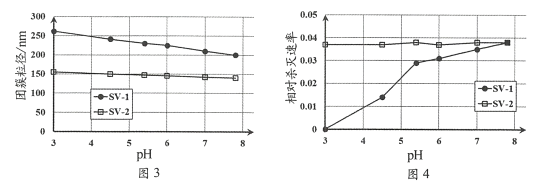
依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。
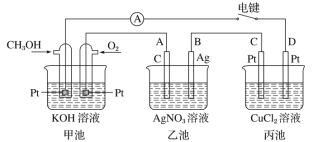
请回答下列问题:
(1)甲池为_______(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为_______。
(2)乙池中A(石墨)电极的名称为_____(填“正极”“负极”“阴极”或“阳极”),总反应式为______。
(3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为___mL(标准状况下),丙池中___极(填C或D)析出___g铜。
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将______(填“增大”“减小”或“不变”);丙中溶液的pH将______(填“增大”“减小”或“不变”)。
(5)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为_____;正极反应式为_______。
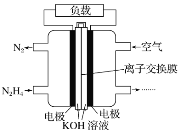
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com