
����Ŀ��һ�ִ���ȩ��ҵ�в����ķ��٣�Pd����������5-6%��̿93-94%������ͭ��п����1-2%������ȡPdCl2��CuCl2�Ĺ���������ͼ��ʾ��
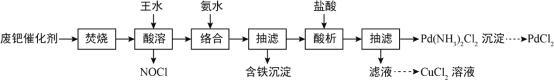
��֪���١�ͭ��п�������백ˮ�γ�Pd(NH3)42+�������ӡ���ش�
��1��������������ҪĿ��Ϊ______________��ʵ�����п���______________�����������ƣ���ģ��ù��̡�
��2����������ʱ��Pdת��ΪPdCl2���仯ѧ����ʽΪ______________���ù��������70-80�����¶Ȳ���̫�ͻ�̫�ߵ�ԭ��Ϊ______________��
��3���������ʱ����Һ��pH��ʼ��ά��8-9������Ϻ���Һ�к������ӵ�Ũ���Q______________������֪��Fe��OH��2��Fe��OH��3��Ksp�ֱ�Ϊ4��10-17��2.8��10-39��
��4����������ʱ���ɳ��������ӷ���ʽΪ______________��
��5�������л��յõ���PdCl2��CuC12����ϩֱ����������ȩ�Ĵ���ϵ�����Ϸ������ã���Ӧ�������£�
i.![]() ��
��
ii.______________��
iii.![]() ��
��
ii�Ļ�ѧ����ʽΪ______________��
��6��������ȡPdCl2��CuCl2������ȱ����______________��д��һ�����ɣ���
���𰸡���ȥ̿��������ʱ��ˮ������ ���� ![]() �¶�̫�ͷ�Ӧ���ʹ������¶�̫����ˮ�ֽ�ӷ�
�¶�̫�ͷ�Ӧ���ʹ������¶�̫����ˮ�ֽ�ӷ� ![]()
![]()
![]() ʹ�ø�ʴ��ǿ����ˮ���豸Ҫ��������
ʹ�ø�ʴ��ǿ����ˮ���豸Ҫ�������� ![]() ����Ⱦ
����Ⱦ
��������
��Pd�ϴ������գ����Գ�ȥ�ϴ����е�C��������ˮ���ɽ���������ת��Ϊ������ʽ���Ա�����Һ�н��к�����������֪�١�ͭ��п�������백ˮ�γ�Pd��NH3��42+�������ӣ����Լ��백ˮ��FeԪ���� ����ʽ��������Һ�е�����Ԫ���������ӵ���ʽ��������Һ�У�����������������ɵõ� ����������һϵ�в�����õ� ��
��1�����յ�Ŀ����Ϊ�˽����ٴ����к���93%��C��ȥ�����Լ��ٺ�����������ˮ��������ʵ������ʹ�����������չ��壬����ʵ�����п���������ģ��ù��̡�
��2����������ʱ��Pd������ΪPdCl2����������ͼ��֪������ʱ�Ļ�ԭ����ΪNOCl���仯ѧ����ʽΪ![]() ���ù��������70-80�����¶ȹ��ͻᣬ���·�Ӧ���ʱȽ������¶ȹ���ʱ����ˮ��ӷ��ֽ⡣
���ù��������70-80�����¶ȹ��ͻᣬ���·�Ӧ���ʱȽ������¶ȹ���ʱ����ˮ��ӷ��ֽ⡣
��3��������ˮ����Һ����Ԫ���� ![]() ��ʽ���ڣ��Ӱ�ˮ��Ϻ���Һ
��ʽ���ڣ��Ӱ�ˮ��Ϻ���Һ ![]() ά����
���� ![]() ����
���� ![]() ʱ��
ʱ��![]() ������Ϊ
������Ϊ  ������Ϻ�������Ũ��
������Ϻ�������Ũ�� ![]() ��
��
��4������ʱ��Һ�� ![]() ���ӽ��
���ӽ�� ![]() �γ�
�γ� ![]() �����������ӷ���ʽΪ��
�����������ӷ���ʽΪ��![]() ��
��
��5����ϩ����Ϊ��ȩ�Ļ�ѧ����ʽΪ  Ϊ��Ӧ���������������ļӺͷ���ʽ���ʻ������Ļ�ѧ����ʽΪ��
Ϊ��Ӧ���������������ļӺͷ���ʽ���ʻ������Ļ�ѧ����ʽΪ��![]() ��
��
��6��������ȡ ![]() ��
�� ![]() ������ȱ����ʹ�ø�ʴ��ǿ����ˮ���豸Ҫ��������
������ȱ����ʹ�ø�ʴ��ǿ����ˮ���豸Ҫ�������� ![]() ����Ⱦ��
����Ⱦ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��ͬѧ����ͼװ�ý���ͭ��Ũ���ᷴӦʱ�������Թ����к�ɫ���ʲ�����ͬѧ�²⣬��ɫ�����п��ܺ���CuO��Cu2S��CuS����Բ����ĺ�ɫ���ʣ���С��ͬѧ��������ʵ��̽��������������������˵������ȷ����
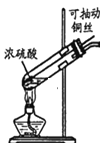
����Ũ��/ mol��L��1 | ��ɫ���ʳ��ֵ��¶��M�� | ��ɫ������ʧ���¶��M�� |
15 | Լ150 | Լ236 |
16 | Լ140 | Լ250 |
18 | Լ120 | ����ʧ |
A.����Ũ��Խ��ɫ����Խ�׳��֡�Խ����ʧ
B.��ɫ������ʧ��������SO2��H2S����
C.����Ũ��Ϊ16 mol��L��1ʱ����������250�����ϣ��ٽ�ͭ˿��Ũ����Ӵ������Ա��������ɫ����
D.ȡ��ɫ����ϴ�ӡ������ϡ�����ֻ�ϣ������������䣬˵����ɫ�����в���CuO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2 L�����ܱ������г���![]() ��
��![]() ����һ�������·������·�Ӧ��
����һ�������·������·�Ӧ��![]()
![]() ��CO��ƽ��ת�������¶ȡ�ѹǿ֮��Ĺ�ϵ��ͼ��ʾ�������ƶ���ȷ���ǣ� ��
��CO��ƽ��ת�������¶ȡ�ѹǿ֮��Ĺ�ϵ��ͼ��ʾ�������ƶ���ȷ���ǣ� ��
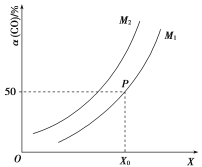
A.��ҵ�ϣ�����������Ӧ�ϳɼ״����¶�Խ��Խ��
B.ͼ����X�����¶ȣ�![]()
C.ͼ����P�������ƽ�ⳣ��KΪ![]()
D.�¶Ⱥ��ݻ����䣬�ٳ���![]() ��1 mol CO���ﵽƽ��ʱCO��ת���ʼ�С
��1 mol CO���ﵽƽ��ʱCO��ת���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NO2��N2O4�����ת����2NO2(g)![]() N2O4(g)����H��0���ֽ�һ����NO2��N2O4�Ļ������ͨ�����Ϊ1L�ĺ����ܱ������У���Ӧ��Ũ����ʱ��仯��ϵ����ͼ������˵���У���ȷ����
N2O4(g)����H��0���ֽ�һ����NO2��N2O4�Ļ������ͨ�����Ϊ1L�ĺ����ܱ������У���Ӧ��Ũ����ʱ��仯��ϵ����ͼ������˵���У���ȷ����

A.��Ӧ���ʣ�v��(b��)��v��(d��)
B.ǰ10min����v(N2O4)��ʾ��ƽ����Ӧ����Ϊ0.04mol/(L��min)
C.25minʱ������ƽ���ƶ���ԭ���������¶�
D.a��c�㣺Qc��Ũ���أ���K��ƽ�ⳣ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������������� ��NaCl�����Һ̬SO2�۱���������ᱵ��ͭ�ƾ���C2H5OH�����ۻ���KCl��NaOH��Һ����ˮ�ⴿ���ᣬ�����������ʻش��������⡣
����ǿ�������������״̬���ܵ������____________������������ʵ���_____________�� ���ڷǵ���ʣ�������ˮ���ˮ��Һ�ܵ������______________��
��2�����ܱ������У�ʹ1 mol N2��3 mol H2��Ϸ������з�Ӧ��N2 (g)+3H2 (g)![]() 2NH3 (g) ��H ��0��
2NH3 (g) ��H ��0��
�ٴﵽƽ��ʱ�� ����N2������������䣬ƽ�⽫______�ƶ�����������������������������������
�ڴﵽƽ��ʱ�����������Ar��������������䣬ƽ�⽫______�ƶ���ͬ�ϣ���
�۴ﵽƽ��ʱ�����������Ar����������ѹǿ���䣬ƽ�⽫______�ƶ���ͬ�ϣ���
�ܴﵽƽ��ʱ����c��N2����c��H2����c��NH3��ͬʱ����1����ƽ��______�ƶ���ͬ�ϣ���
�ݱ���������䣬�����¶�ʱ����������ƽ����Է�������______���ܶ�_______�����������������С����������������
����Ӧ�ﵽƽ��ʱ��N2��H2��Ũ�ȱ���______��N2��H2��ת���ʱ���______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С��������KMnO4��Һ�Ͳ��ᣨH2C2O4����Һ��Ӧ���о����������Ӧ���ʵ�Ӱ�죬ʵ��������������£�
��� | ʵ����� | ʵ������ |
I | ��һ֧�Թ����ȼ���1mL 0.01 mol/L���� KMnO4��Һ���ټ���1��3mol/L�����9������ˮ��������1mL 0.1mol/L������Һ | ǰ10min����Һ��ɫ�����Ա仯������ɫ��dz�� 30 in����Ϊ��ɫ |
II | ����һ֧�Թ����ȼ���1mL 0.01mol/L���� KMnO4��Һ���ټ���10��3mol/L���ᣬ������1mL 0.1mol/L������Һ | 80s����Һ��ɫ�����Ա仯������ɫѸ�ٱ�dz��Լ150s����Ϊ��ɫ |
��1�������������ᷴӦ�����ӷ���ʽ��______________________________________
��2����ʵ��I��II�ɵó��Ľ�����____________________________��
��3������ʵ��II��80s����Һ��ɫѸ�ٱ�dz��ԭ��С������˲��룺�÷�Ӧ�����ɵ�Mn2+�Է�Ӧ�д����á������ṩ���Լ����ʵ��III����֤���롣
�ṩ���Լ���0.01mol/L���� KMnO4��Һ��0.1mol/L������Һ��3mol/L���ᣬMnSO4��Һ��MnSO4���壬����ˮ
�� ��ȫʵ��III�IJ��������Թ����ȼ���1mL 0.01mol/L���� KMnO4��Һ��______��������1mL 0.1mol/L������Һ��
�� �����������Ӧ�۲쵽��ʵ��������______��
��4����С���������ͼ��ʾ��ʵ�鷽������̽����������Է�Ӧ���ʵ�Ӱ�졣
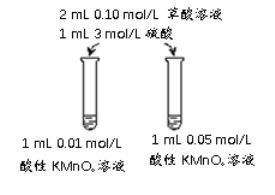
�� �������о���Ӱ��������______��
�� ����Ϊ���ǵ�ʵ�鷽��______����������������������������������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г����Լ������ѡ�ò���ȷ����( )
����(������Ϊ����) | �����Լ������ | |
A | Na2CO3����(NaHCO3) | ���� |
B | CO2(HCl) | �����Ȼ�����Һ��ŨH2SO4��ϴ�� |
C | Fe2O3(SiO2) | NaOH ��Һ������ |
D | ϡ����(Cl2) | ���� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH��2��A��B����һԪ����Һ��1mL, �ֱ��ˮϡ�͵�1000mL,����Һ��pH����Һ���(V)�Ĺ�ϵ��ͼ��ʾ, ������˵����ȷ����

A. A��B��������Һ���ʵ���Ũ��һ�����
B. ϡ�ͺ�A����Һ�����Ա�B����Һǿ
C. a �� 5ʱ, A������, B��ǿ��
D. ��A��B��������, ��5 > a > 2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2S��һ�ִ�����Ⱦ���ҵβ���к���H2S����������صĻ�����Ⱦ��δ�ѳ�H2S��ú������������л��ḯʴ�ܵ���
(1)�ɷ�������������Ŀǰ��ȥú����H2S�ij��÷�������ԭ����ͼ��ʾ��
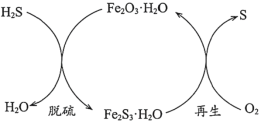
������˵����ȷ����____________(�����)��
a.������Ϊ����ɫ����
b.����ӦΪ3H2S+Fe2O3��H2O=3H2O+Fe2S3��H2O
c.���������У���Ԫ�ر���ԭ
d.��������У�����Ӧ��ĽӴ�������������Ч��
�ڴӰ�ȫ�����ĽǶȿ��ǣ�������������Ʒ�Ӧ�¶Ȳ��ܹ��ߵ�ԭ����_______��
(2)�绯ѧ�ܽ�һ��������һ�ֻ�������H2S���·������乤��ԭ������ͼ��ʾ��
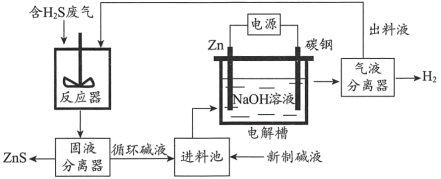
��֪: Zn��ǿ�ᡢǿ��ܷ�Ӧ����H2��Zn(II)�ڹ�����ǿ����Һ����[Zn(OH)4]2-��ʽ���ڡ�
��п������ֱ����Դ��____________(�������������)��
�ڷ�Ӧ���з�Ӧ�����ӷ���ʽΪ____________��
�۵����У�û��ͨ��Դʱ�Ѿ���H2�������û�ѧ�������ԭ��:___________��
(3)���õ������ⶨú����H2S�ĺ�������ʵ��������£�
i.��10Lú��ͨ��ʢ��100mLп�����Һ��ϴ��ƿ�У������е�H2Sȫ��ת��ΪZnS����������;
ii.�����г�������ֽ����ʢ��15mL 0.1mol/L���Һ��200mLˮ��10mL����ĵ���ƿ�У�����ƿ����ҡ������ƿ��ƿ����ֽҡ�飬���ڰ�����Ӧ10 min��������ˮ��ϴƿ�ں�ƿ����(��֪:ZnS+I2=ZnI2+S)
iii.��0.1mol/L Na2S2O3��Һ�ζ�������Һ�ʵ���ɫʱ������1mL����ָʾ���������ζ����յ㡣(��֪:2Na2S2O3+I2=Na2S4O6+2NaI)
��i�У���ú���е�H2Sת��ΪZnS��Ŀ����____________��
�ڵζ��յ��������__________________��
��������Na2S2O3��Һ�����Ϊ20mL����ú����![]() �ĺ���Ϊ_______________mg/m3��
�ĺ���Ϊ_______________mg/m3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com